同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:
[提出问题]1.金属钠能否置换出硫酸铜溶液中的铜?2.金属钠能否在其他气体(如:CO
2)中燃烧?
[查阅资料]金属Na性质活泼,常温下,它极易与氧气反应生成白色固体氧化钠,氧化钠溶于水生成氢氧化钠.金属钠还可以与水剧烈反应放出氢气.
[实验探究]实验一:①在实验室中,金属钠保存在煤油中;②用镊子从煤油中取出一小块金属钠,用滤纸吸干表面煤油后投入硫酸铜溶液中,观察到溶液中出现蓝色沉淀,但没有红色的物质析出;
③按照步骤②将金属钠投入水中,待反应结束后滴加酚酞溶液,发现溶液变红.
实验二:将燃烧的钠迅速伸入盛有CO
2的集气瓶中,观察到钠在CO
2中继续燃烧,反应后冷却,瓶内附着黑色颗粒,并粘附着白色物质.
[问题讨论](1)金属钠保存在煤油中的原因
钠易与氧气反应变质
钠易与氧气反应变质
.
(2)根据上述资料写出钠块投入水中所发生的反应方程式:
2Na+2H2O═2NaOH+H2↑
2Na+2H2O═2NaOH+H2↑
;钠投入硫酸铜溶液中总的反应方程式:
2Na+2H2O+CuSO4=H2↑+Cu(OH)2↓+Na2SO4
2Na+2H2O+CuSO4=H2↑+Cu(OH)2↓+Na2SO4
.氢氧化铜受热分解成氧化铜和水,若将24.0g剩余固体继续高温加热,发现固体质量减少了2.4g后质量不再改变,写出此过程中可能发生反应的化学方程式:
.
(3)实验二中生成的黑色颗粒是
C
C
,而白色物质可能是什么呢?
①同学们围绕白色物质可能是什么产生如下猜想:甲认为白色物质是Na
2O,乙认为是Na
2CO
3,丙认为是Na
2O和Na
2CO
3的混合物,丁认为是NaOH.
我认为认为丁的猜想是错误的,理由是
反应物中没有氢元素
反应物中没有氢元素
.
②对白色物质是什么进行实验再探究,方案设计如下:
方案1:取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入无色酚酞试液,观察到溶液变成红色,结论:白色物质中一定有Na
2O.
方案2:取该样品少量于试管里,滴加足量稀盐酸,溶液中有气泡冒出,结论:白色物质中一定有
碳酸钠
碳酸钠
.
方案3:取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入过量的
B
B
溶液(供选试剂:A.石灰水B.氯化钙溶液 C.硫酸铜溶液),出现白色沉淀,然后过滤,再向溶液里滴加无色酚酞试液,无明显现象出现.则
乙
乙
(在甲、乙、丙中选)的猜想成立.
③评价与反思:大家认为实验方案1得出的结论不正确,其理由是
碳酸钠溶液也是碱性的
碳酸钠溶液也是碱性的
;
实验室中的金属钠着火时,你的灭火方法是
用黄沙掩埋
用黄沙掩埋
.
[拓展应用]小明同学为测定实验过程中所用的标示质量分数为32%的盐酸 (图1)的实际质量分数,他与小组的其他同学用pH测定仪组成实验装置(图2).实验时先在烧杯中加入20g 40%的氢氧化钠溶液,再逐滴加人该盐酸,测定仪打印出加入盐酸的质量与烧杯中溶液pH的关系图(图3).

①发生反应的化学方程式为:
HCl+NaOH=NaCl+H2O
HCl+NaOH=NaCl+H2O
_.
②请以此次测定的结果,可计算出该盐酸的实际质量分数是
29.2%
29.2%
.
③请分析你的计算结果与标签标示的质量分数不一致的可能原因:
浓盐酸具有挥发性,长期放置质量分数减小
浓盐酸具有挥发性,长期放置质量分数减小
.

 Cu+CO2 CO2+C
Cu+CO2 CO2+C 2CO
2CO  2CO CuO+CO
2CO CuO+CO Cu+CO2 CO2+C
Cu+CO2 CO2+C 2CO
2CO

 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 20、通过“金属和金属材料”和“燃烧”的复习,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:
20、通过“金属和金属材料”和“燃烧”的复习,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题: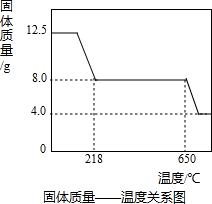 某企业是一家以生产电缆类产品为主的地方明星企业.在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组的同学得知这一情况后,提出可以用含铜废料制备胆矾(CuSO4?5H2O).
某企业是一家以生产电缆类产品为主的地方明星企业.在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组的同学得知这一情况后,提出可以用含铜废料制备胆矾(CuSO4?5H2O).

