

分析 (1)在锥形瓶内装适量的水,使长颈漏斗末端浸没在液面以下,将活塞缓慢往外拉,若观察到长颈漏斗末端有气泡冒出,则装置不漏气;
(2)A装置适用于固体加热制取氧气,根据氧气的收集方法来分析;
(3)若用C装置(多孔隔板用来放块状固体)作为制取二氧化碳的发生装置,优点是可以控制反应的发生和停止.
解答 解:(1)利用注射器可以检查装置B的气密性.如图2所示,在锥形瓶内装适量的水,使长颈漏斗末端浸没在液面以下,将活塞缓慢往外拉,若观察到长颈漏斗末端有气泡冒出,则装置不漏气;故答案为:长颈漏斗末端有气泡冒出;
(2)A装置适用于固体加热制取氧气,且试管口没有棉花团,所以是加热氯酸钾与二氧化锰的混合物生成氯化钾和氧气来制取;排水法收集的氧气比价纯净;故填:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑;F;
(3)若用C装置(多孔隔板用来放块状固体)代替B装置为制取的发生装置,优点是:可以控制反应的发生和停止;故答案为:可以控制反应的发生和停止.
点评 本考点主要考查了气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和注意事项等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 所有溶液中的溶剂均为水 | |
| B. | 受热时水分子的体积逐渐变大 | |
| C. | 衣服晒干过程中水分子分解为气体 | |
| D. | 与肥皂水混合能产生大量泡沫的是软水 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
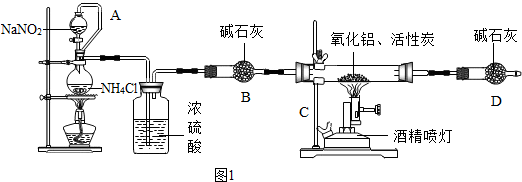
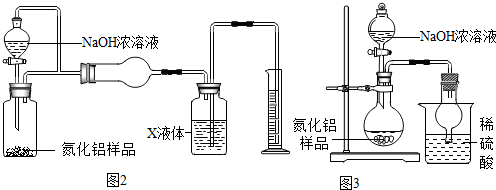
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
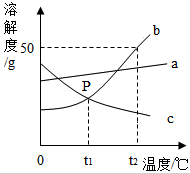 根据图中a、b、c三种物质的溶解度曲线,回答下列问题:
根据图中a、b、c三种物质的溶解度曲线,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
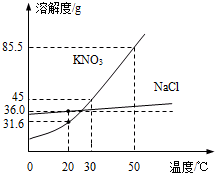 如图为NaCl、KNO3的溶解度曲线(水的密度约为1g/cm3).
如图为NaCl、KNO3的溶解度曲线(水的密度约为1g/cm3).查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 增加私家车用量,提高生活质量 | |
| B. | 大力发展风能,减少火力发电 | |
| C. | 农作物秸秆多翻土还田,不露天焚烧 | |
| D. | 居民多用天然气,少用煤作燃料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com