
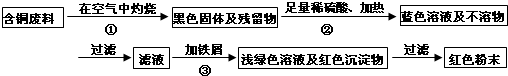
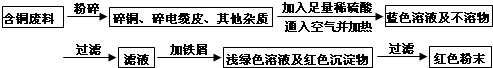
分析 “从含铜废料中回收铜”符合绿色化学的理念,再回收利用中,设计了两套方案,处理有关问题,并进行评价.甲方案中:发生的有关化学方程式为:①2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;②CuO+H2SO4═CuSO4+H2O;③Fe+CuSO4═FeSO4+Cu.但“灼烧”会产生污染空气的气体、粉尘、烟雾,所以不如乙方案更合理;然后设计提取的有关问题;最后考查学生的计算能力及体验回收成果,增强成就感.
解答 解:(1)由题意,甲方案中:发生的有关化学方程式为:①2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;②CuO+H2SO4═CuSO4+H2O;③Fe+CuSO4═FeSO4+Cu;
(2)从环保的角度,乙方案更合理,甲方案的“灼烧”会产生污染空气的气体、粉尘、烟雾;
(3)加入略过量的铁屑的目的是“确保CuSO4用完”或“将Cu完全置换出来”;
(4)多余的铁粉可以利用铁和酸反应除去;
(5)蒸发、降温都能使“绿矾”结晶出来,直接排放掉滤液,不仅造成了浪费,还会造成环境污染或水污染;
(6)设稀硫酸的质量为x,则36.8%x=1000mL×1.84g/mL×98%,得x=4900g;需要水的体积:(4900g-1000mL×1.84g/mL)÷1.0g/mL=3060mL;
稀释浓硫酸的方法是:将浓硫酸沿烧杯壁缓缓倒入水中,并用玻璃棒不断搅拌;
(7)由题意,列式计算即可.
故答案为:(1)①2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;②CuO+H2SO4═CuSO4+H2O;③Fe+CuSO4═FeSO4+Cu;
(2)乙;甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾;
(3)“确保CuSO4用完”或“将Cu完全置换出来”(合理即可);
(4)将所得铜粉酸洗后再洗涤、干燥或过滤前在加适量的酸以除去剩余的铁粉;
(5)蒸发、降温;水污染或环境污染;
(6)4900,3060;将浓硫酸沿玻璃棒加入水中;
(7)解:设所能处理的废料中纯铜质量为x.
2Cu+2H2SO4+O2?2CuSO4+2H2O
2×64 2×98
x 1000mL×1.84g/mL×98%
$\frac{2×64}{x}$=$\frac{2×98}{1000mL×1.84g/mL×98%}$
x=1177.6g
答:所能处理的废料中含纯铜1177.6克.
点评 本题探讨了“从含铜废料中回收铜”的有关问题,设计了不同的方案,并进行评价,考察了考生的思考、探讨、评价等诸多能力.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用带火星的木条 | B. | 分别称取各自的质量 | ||
| C. | 倒入澄清的石灰水 | D. | 用燃着的木条 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
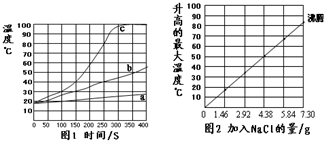 无焰食品加热器常用于野外加热食物,它的成分是镁粉、铁粉、氯化钠.使用时加入水,镁和水反应产生热量.下面是在18℃、标准大气压的环境中对该产品的实验研究,请结合以下方案回答有关问题(不考虑氯化钠对水沸点的影响).
无焰食品加热器常用于野外加热食物,它的成分是镁粉、铁粉、氯化钠.使用时加入水,镁和水反应产生热量.下面是在18℃、标准大气压的环境中对该产品的实验研究,请结合以下方案回答有关问题(不考虑氯化钠对水沸点的影响).查看答案和解析>>
科目:初中化学 来源: 题型:解答题
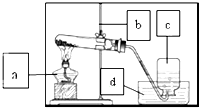 某校研究性学习小组到实验室进行探究实验.他们准备用加热高锰酸钾的方法制取氧气并验证氧气的性质
某校研究性学习小组到实验室进行探究实验.他们准备用加热高锰酸钾的方法制取氧气并验证氧气的性质查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com