
 一课一练课时达标系列答案
一课一练课时达标系列答案 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:初中化学 来源:不详 题型:计算题
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 2.3 | 4.0 | 开始溶解:7.8 |
| 完全沉淀时的pH | 3.7 | 5.2 | 完全溶解:10.8 |
查看答案和解析>>
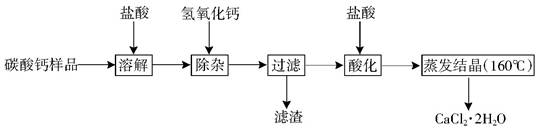
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
| 现象 | 结论 |
| (12) | 滤液中的溶质是FeSO4 |
| 有红色固体析出 | 滤液中的溶质可能有哪几种情况? (13) |
| (14) | 滤液中的溶质是 (15) |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
| | 部分性质 | 生理作用 |
| 葡萄糖 化学式: C6H12O6 | 白色结晶或颗粒状粉末,味甜;易溶于水;具有还原性,葡萄糖溶液与新制氢氧化铜悬浊液反应生成砖红色沉淀 | 葡萄糖为机体所需能量的主要来源,能促进肝脏的解毒功能,对肝脏有保护作用 |

 C6H12O7+Cu2O↓+2H2O
C6H12O7+Cu2O↓+2H2O 查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题

| | 第一次 | 第二次 | 第三次 | 平均值 |
| B装置增加的质量 | 2.17 | 2.22 | 2.21 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com