
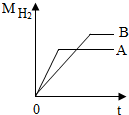
 等质量的A、B两种活泼金属(化合价均为+2价)与足量稀盐酸反应,7产生H2质量与反应时间的函数关系如图所示.
等质量的A、B两种活泼金属(化合价均为+2价)与足量稀盐酸反应,7产生H2质量与反应时间的函数关系如图所示.分析 考虑氢前的金属可以与酸反应生成氢气,金属的活动性越强,与酸反应的速率越快.依据根据化学方程式可以判断金属的相对原子质量大小,得到的通式是“足量稀盐酸”,等质量的二种金属完全反应,放出氢气的质量=$\frac{金属的化合价}{金属的相对原子质量}$×金属质量;因此得到都生成相同价态盐酸盐,两种物质的质量相等,则产生的氢气越多,相对分子质量越小.
解答 解:(1)等质量的金属完全反应时A用的时间较少,则反应速度较快,其活动性较强.
(2)依据根据化学方程式可以判断金属的相对原子质量大小,得到的通式是“足量稀盐酸”,等质量的二种金属完全反应,放出氢气的质量=$\frac{金属的化合价}{金属的相对原子质量}$×金属质量;因此得到都生成相同+2价盐酸盐,两种金属的质量相等,则产生的氢气越多,相对分子质量越小,B生成的氢气较多,相对原子质量则较小,相对原子质量是A>B;
(3)利用氢前的金属可以与酸反应生成氢气,可判断Zn和Cu组合不正确,因为铜不能与酸反应生成氢气,结合(1)(2)的结论可判断:A、B两种金属可能分别是Zn和Fe.
故答案为:
(1)强于; (2)大于; (3)Zn和Fe.
点评 此题主要是对金属活动性顺序的考查,得到了一个重要的规律:质量相等的金属与足量酸完全反应放出氢气的多少与金属的相对原子质量成反比,与金属的化合价相成正比.


 53随堂测系列答案
53随堂测系列答案科目:初中化学 来源: 题型:选择题
| A. | 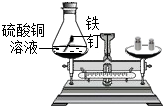 可以验证质量守恒定律 | |
| B. |  常温下,二氧化碳能溶于水 | |
| C. | 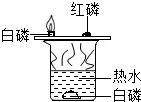 只能探究可燃物的燃烧需要的一个条件 | |
| D. | 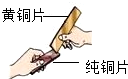 黄铜的硬度比纯铜的大 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 阅读下列材料,回答问题
阅读下列材料,回答问题| A | B | C | D | |
| 实 验 装 置 |  硫在氧气中燃烧 |  测定空气中氧气含量 | 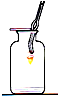 铁丝在氧气中燃烧 | 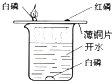 探究燃烧的条件 探究燃烧的条件 |
| 作用 | 瓶中的水: 吸收生成的气体,防止污染空气 | 量筒中的水: 通过水体积的变化得出O2体积 | 瓶中的水: 冷却溅落融熔物,防止集气瓶炸裂 | 烧杯中的水: 隔绝空气,加热铜片上的白磷和红磷. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com