

分析 【实验探究】
(1)根据氢氧化钠与盐酸的反应、溶液的酸碱性的变化分析回答有关的问题;
(2)根据溶液温度的变化、酸碱度的变化分析回答;
【实验反思】
利用对比试验探究溶液的酸碱中反应是放热反应;
【实验拓展】
根据酸碱的性质分析设计实验方案证明氢氧化钠溶液与稀盐酸确实发生反生了化学反应.
解答 解:【实验探究】
(1)氢氧化钠溶液能够使酚酞变红,所以将酚酞滴入氢氧化钠溶液中后会观察到溶液变红,而酚酞在中性和酸性溶液中呈无色,所以当向滴加了酚酞的氢氧化钠溶液中滴加盐酸会发现溶液的红色逐渐减弱,最终会变成无色;通过观察实验过程可以知道,随着盐酸的滴入,溶液碱性逐渐减弱.这是由于盐酸和氢氧化钠溶液发生了中和反应,反应的化学方程式为:HCl+NaOH=NaCl+H2O.
(2)由图象可见随着盐酸的滴入,一段时间内溶液的温度升高,溶液pH明显下降直至7以下,说明氢氧化钠溶液和盐酸发生了化学反应,且该反应是个放热反应.据图可知,当溶液pH=7和温度达最高值时,对应的时间大约为50秒.
【实验反思】
分别用水稀释原氢氧化钠溶液和盐酸,用温度传感器监测温度变化.可分别排除氢氧化钠溶液和盐酸稀释放热的可能.使原实验更具说服力.
【实验拓展】
氢氧化钠具有碱性,会与硫酸铜反应生成氢氧化铜沉淀,所以可以加入硫酸铜,无蓝色沉淀说明溶液中无氢氧化钠存在,即可说明二者发生了反应.盐酸具有酸性可以和氢前金属、碳酸盐等反应产气,在氢氧化钠溶液中加入铁钉,开始加入稀盐酸不产气,说明盐酸与氢氧化钠反应被消耗,说明二者发生了反应.所以实验方案是:
方案一:向氢氧化钠溶液中加入过量的稀盐酸,然后加入硫酸铜,无蓝色沉淀生成,说明氢氧化钠被盐酸消耗.证明二者发生了化学反应.
方案二:向适量氢氧化钠溶液中加入一根打磨过的铁钉,无气泡产生,再逐滴加入稀盐酸,一段时间后才有气泡产生,说明开始滴入的盐酸被氢氧化钠消耗等.
故答为:【实验探究】
(1)溶液由无色变为红色又由红色变为无色;减弱; 氢氧化钠与盐酸发生了反应被消耗;HCl+NaOH=NaCl+H2O.
(2)一段时间内溶液的温度升高,而溶液pH明显下降直至7以下;填45~55都对
【实验反思】分别用等量的水替代盐酸和氢氧化钠溶液,稀释原氢氧化钠溶液和盐酸,用温度传感器监测温度变化.温度无明显变化,则说明溶液温度升高是二者反应产生的.
【实验拓展】(答案开放,合理即可)
方案一:向氢氧化钠溶液中加入过量的稀盐酸,然后加入硫酸铜,无蓝色沉淀生成,说明氢氧化钠被盐酸消耗.证明二者发生了化学反应.
方案二:向适量氢氧化钠溶液中加入一根打磨过的铁钉,无气泡产生,再逐滴加入稀盐酸,一段时间后才有气泡产生,说明开始滴入的盐酸被氢氧化钠消耗.
点评 本题主要考查实验设及分析计能力、转化的思想、酸和碱的化学性质、中和反应及化学方程式书写等知识.


科目:初中化学 来源: 题型:选择题
| A. | 冰、干冰、赤铁矿 | B. | 氢气、生石灰、煤 | ||
| C. | 红磷、纯碱、石油 | D. | 金刚石、熟石灰、空气 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选 项 | 归 类 | 物 质 |
| A | 合金 | 水银、焊锡、生铁 |
| B | 氧化物 | 水、氧气、过氧化氢 |
| C | 常见干燥剂 | 碱石灰、熟石灰、活性炭 |
| D | 常见营养物质 | 蛋白质、维生素、葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Ag | B. | Cu | C. | Zn | D. | Mg |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
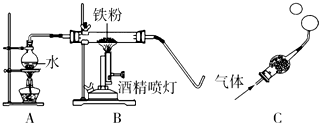
| 常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 能否被磁铁吸引 | 否 | 否 | 能 |
| 能否与盐酸反应 | 能 | 能 | 能 |
| 实验操作 | 实验现象及结论 |
| ④取少量黑色固体于试管中,加入足量的稀盐酸 | ⑤若固体全部溶解,没有气泡冒出,则猜想二正确;若固体全部溶解,有气泡冒出,则猜想一正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 猜想1 | 猜想2 | 猜想3 |
| 只有CO | 只有 | 含有CO和CO2 |
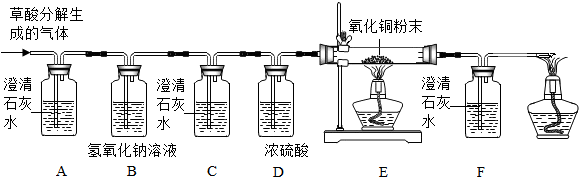
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 实验操作 | 实验现象 | 实验结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 固体A、B的溶解度曲线如图所示.
固体A、B的溶解度曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com