
某兴趣小组在实验室发现一瓶敞口久置的氢氧化钠和一瓶未标浓度的稀盐酸。为测定氢氧化钠的变质情况和稀盐酸的浓度,他们取9.3g变质的氢氧化钠样品于锥形瓶中,加人50g水,充分溶解,再向锥形瓶中滴加未知浓度的稀盐酸。实验测得加入稀盐酸的质量与锥形瓶中物质的质量关系如下图所示。
求:(1)9.3g样品中碳酸钠的质量。
(2)未知浓度的稀盐酸的溶质质量分数。
【答案】解:由图中的质量关系图可知:
产生CO2的质量是(9.3g+50g+50g)-107.1g=2.2g
设9.3g样品中Na2CO3的质量为x,与Na2CO3反应的HCl的质量为y,与NaOH反应的HCl的质量为
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 73 44
X y 2.2、
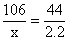
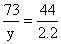
X=5.3g y=3.65g
HCl + NaOH== NaCl + H2O
36.5 40
9.3g-5.3g z
Z=3.65g
稀盐酸的质量分数=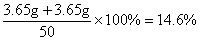
答:9.3g样品中碳酸钠的质量为5.3g,稀盐酸是质量分数为14.6%
【解析】由图中的质量关系图可知:产生CO2的质量是(9.3g+50g+50g)-107.1g=2.2g
设9.3g样品中Na2CO3的质量为x,与Na2CO3反应的HCl的质量为y,与NaOH反应的HCl的质量为
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 73 44
X y 2.2、
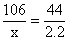
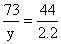
X=5.3g y=3.65g
HCl + NaOH== NaCl + H2O
36.5 40
9.3g-5.3g z
Z=3.65g
稀盐酸的质量分数=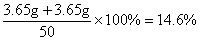
答:9.3g样品中碳酸钠的质量为5.3g,稀盐酸是质量分数为14.6%


科目:初中化学 来源: 题型:
生活中常用到各种干燥剂(能除去潮湿物质中水分的物质)。
(1)硅胶是无色或白色颗粒,其主要成分是SiO2,其中Si元素的化合价为_____。
(2)生石灰是白色块状固体,吸水后变成粉末,该反应的化学方程式是_____,该反应可用于自发热饭盒的原因是______。
(3)分子筛干燥剂是铝硅酸盐化合物,其晶体结构中有规整而均匀的孔道,只允许直径比孔径小的分子进入,能吸附水气和其 它气体,吸湿速度极快。分子筛干燥剂吸水前后的变化属于______变化(填“物理”或“化学”)。
它气体,吸湿速度极快。分子筛干燥剂吸水前后的变化属于______变化(填“物理”或“化学”)。
(4)“双吸剂”的主要成分是还原铁粉,常用于食品保鲜,其原因是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
小英同学为了侧定某地区石灰石样品中碳酸钙的质量分数,取该样品15g,现将75m1的稀盐酸分三次加人石灰石样品中,每次充分反应后测得生成气体的质量,实验数据如下表:
| 实验 | 第一次 | 第二次 | 第三次 |
| 加人稀盐酸的量/ml | 25 | 25 | 25 |
| 生成气体的质量/g | 2.2 | m | 1.1 |
试求:
(1)m的值是 g。
(2)求该样品中碳酸钙的质量分数(保留一位小数)?
查看答案和解析>>
科目:初中化学 来源: 题型:
某混合物中含有碳酸钙和氯化钙,取该混合物6g,向其中加入一定质量的质量分数为10%的稀盐酸,恰好完全反应,产生2.2g气体。(假设气体全部逸出)。
计算:
(1) 所取混合物中碳酸钙的质量。
(2) 所加稀盐酸的质量
(3) 反应后所得溶液中的质量分数(计算结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
向26.4 g 硫酸钠和碳酸钠的混合物中滴加硫酸溶液,直到不再产生气体为止(假设气体全部逸出),共用去98 g质量分数为10%的硫酸溶液。求:
(1)原混合物中碳酸钠的质量。
(2)反应后溶液中溶质的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
将20g生锈的铁片放入50g稀盐酸中,恰好完全反应,放出气体的质量为0.4g。试求:
(1)铁片中单质铁的质量
(2)铁片中铁锈的质量分数
(3)最后所得溶液的质量
查看答案和解析>>
科目:初中化学 来源: 题型:
欲测定某锌-铜合金中铜的质量分数,进行如下实验:取合金样品10g放入烧杯中,将60g稀硫酸分三次加入,充分反应后,测得生成气体的质量如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 加入稀硫酸质量/g | 20 | 20 | 20 |
| 生成气体质量/g | 0.08 | m | 0.04 |
请回答下列问题并计算:
(1)第二次实验时生成气体质量m= g;
(2)计算该合金样品中铜的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
硫酸是化工生产中重要的酸,其产量最大,用途最广,消耗量最多。历史上曾将硫酸的产量或消耗量作为一个国家化工生产发达程度的标志。
浓硫酸具有吸水性、脱水性和强氧化性。浓硫酸的腐蚀性主要是由它的脱水性和强氧化性引起的。稀硫酸有强酸性,稀硫酸的腐蚀性则主要是由酸性及水分蒸发后变浓而产生的。
 硫酸的用途极广,常用于生产化肥、冶炼金属、农药、制药等。
硫酸的用途极广,常用于生产化肥、冶炼金属、农药、制药等。
工业制硫酸的流程为:FeS2 SO2 SO2 H2SO4
(1)综合分析以上材料,并结合已有知识,请回答:
①工业制H2SO4可能会引起的环境问题是 。
②在实验室中不慎将浓硫酸 沾到皮肤上的处理方法是 。
沾到皮肤上的处理方法是 。
A.立即用大量水冲洗,然后再涂上3%~5%的碳酸氢钠溶液。
B.立即用稀氢氧化钠溶液冲洗,然后再用水冲洗。
(2)某工厂化验室用9.8%的稀硫酸洗涤一定量化工产品中残留Ba(OH)2,当消耗稀硫酸100g时,沉淀不再产生,问此时液体的pH= 7 (不考虑其它物质的影响),求化工产品中残留Ba(OH)2的质量。
查看答案和解析>>
科目:初中化学 来源: 题型:
有关维生素的说法错误的是( )
A.缺乏维生素A会引起夜盲症
B.缺乏维生素C会引起坏血病
C.人体所需的维生素可从蔬菜和水果中获得
D.维生素在人体内需要量很少,作用不太大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com