将5.6g铁放入121.6g稀盐酸中恰好完全反应.求:
(1)生成氢气的质量.
(2)反应后溶液中溶质的质量分数.
【答案】
分析:现根据5.6g铁的质量算出生成氢气的质量,再根据5.6g铁的质量算出生成氯化亚铁的质量,用氯化亚铁的质量除以反应后所得溶液的质量乘以百分之百求出反应后溶液中溶质的质量分数.
解答:解:设5.6g铁放入121.6g稀盐酸中生成氢气质量为X,同时生成氯化亚铁的质量为Y则:
Fe+2HCl═FeCl
2+H
2↑
56 127 2
5.6g Y X
根据:
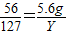
解得Y=12.7g,根据:
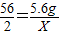
解得X=0.2g.
(1)生成氢气质量为0.2g;
(2)反应后所得溶液的质量为:5.6g+121.6g-0.2g=127g,所以反应后溶液中溶质的质量分数为:
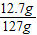
×100%=10%.
故答案为:(1)0.2g;(2)10%.
点评:解答本题的关键是在计算反应后所得溶液质量时有可能忽略生成氢气的质量,需要减去生成氢气的质量.

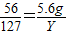 解得Y=12.7g,根据:
解得Y=12.7g,根据: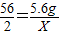 解得X=0.2g.
解得X=0.2g.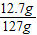 ×100%=10%.
×100%=10%.
