
 一定温度下将某硝酸钾溶液分成两等份,一份等温蒸发10克水,得到m克无水晶体;另一份等温蒸发12.5克水,得到3m克无水晶体,则该温度下硝酸钾的溶解度为( )
一定温度下将某硝酸钾溶液分成两等份,一份等温蒸发10克水,得到m克无水晶体;另一份等温蒸发12.5克水,得到3m克无水晶体,则该温度下硝酸钾的溶解度为( )| A. | 10m克 | B. | 24m克 | C. | 80m克 | D. | 无法确定 |
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:实验探究题
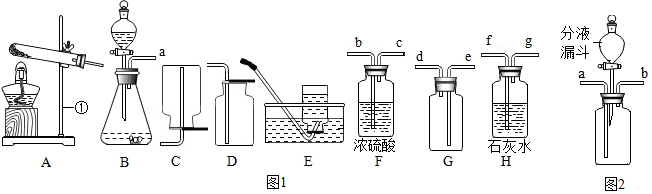
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CO和C60都属于化合物 | B. | 氮气和氧气都属于非金属单质 | ||
| C. | H2O和C2H5OH都属于氧化物 | D. | 自来水和蒸馏水都属于纯净物 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
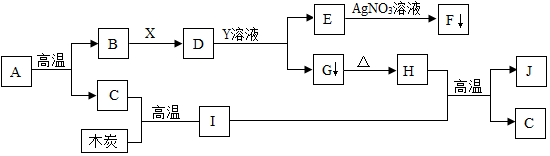
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
| 浓硫酸(H2SO4)500毫升 | |
| 溶质的质量分数 | 98% |
| 密度 | 1.84克/厘米3 |
| 相对分子质量 | 98 |
| 强腐蚀性,阴冷,密封储藏 | |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
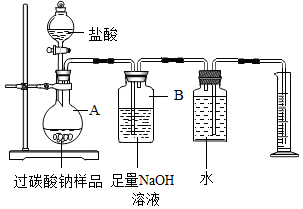 “氧泡泡”系列产品去污能力强、绿色环保,已成为中国氧系清洁品类领导品牌,其主要成分是过碳酸钠(2Na2CO3•3H2O2).某化学活动小组对过碳酸钠产生了浓厚的兴趣,决定对其进行探究.
“氧泡泡”系列产品去污能力强、绿色环保,已成为中国氧系清洁品类领导品牌,其主要成分是过碳酸钠(2Na2CO3•3H2O2).某化学活动小组对过碳酸钠产生了浓厚的兴趣,决定对其进行探究.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
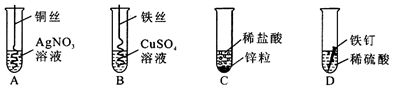
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  浓硫酸 | B. |  冰水混合物 | C. |  24K黄金 | D. |  液化石油气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com