
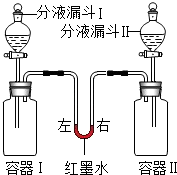
| 实验 编号 | 容器Ⅰ | 分液漏斗Ⅰ | 容器Ⅱ | 分液漏斗Ⅱ | 红墨水液面位置 |
| A | 二氧化碳 (充满) | 10mL澄清 石灰水 | 二氧化碳 (充满) | 10mL水 | 左侧高右侧低 |
| B | 二氧化碳 (充满) | 10mL澄清 石灰水 | 二氧化碳 (充满) | 10mL浓氢氧化钠溶液 | ① |
| C | 0.65g锌 | 10mL盐酸 | 镁 | 10mL盐酸 | 室温时恢复至起始状态 |
分析 (1)从二氧化碳和澄清的石灰水反应生成不溶于水的碳酸钙和水;容器Ⅱ中水和二氧化碳反应生成碳酸去分析;
(2)由氢氧化钙微溶于水,而氢氧化钠极易溶于水,相同时的水里含有的氢氧化钠要比氢氧化钙多很多,所以等体积的氢氧化钠溶液比石灰水消耗的二氧化碳多去分析;
(3)由上表中可以看出红墨水液面位置在室温时恢复至起始状态,说明容器Ⅰ和容器Ⅱ气压相等,即二容器内气体体积相同.由于题目中指出盐酸足量,故氢气的量可能金属的质量进行计算.由下面化学方程式:Zn+2HCl=ZnCl2+H2↑;Mg+2HCl=MgCl2+H2↑;得出关系进行计算即可.
解答 解:(1)二氧化碳和澄清的石灰水反应生成不溶于水的碳酸钙和水,所以看到的现象为:石灰水变浑浊;容器Ⅱ中水和二氧化碳反应生成碳酸,其反应的化学方程式为:H2O+CO2=H2CO3;故答案为:石灰水变浑浊 H2O+CO2=H2CO3;
(2)由于氢氧化钙微溶于水,而氢氧化钠极易溶于水,相同时的水里含有的氢氧化钠要比氢氧化钙多很多,所以等体积的氢氧化钠溶液比石灰水消耗的二氧化碳多,故容器Ⅱ内二氧化碳气体减少的要比容器Ⅰ多,故容器Ⅱ内气压小于容器Ⅰ内的气压;故会看到左侧低右侧高;
故答案为:右侧高左侧低 等体积的氢氧化钠溶液比石灰水消耗的二氧化碳多.
(3)由上表中可以看出红墨水液面位置在室温时恢复至起始状态,说明容器Ⅰ和容器Ⅱ气压相等,即二容器内气体体积相同.由于题目中指出盐酸足量,故氢气的量可能金属的质量进行计算.由下面化学方程式:Zn+2HCl=ZnCl2+H2↑;Mg+2HCl=MgCl2+H2↑;可得如下关系:
Zn~H2~Mg
解:设镁的质量为X.
Zn~H2~Mg
65 24
0.65g x
$\frac{65}{24}=\frac{0.65g}{x}$
解之得:
X=0.24g
故答案为:0.24.
点评 本题综合性强,考查了二氧化碳的检验、二氧化碳和水的反应、氢氧化钠和氢氧化钙吸收二氧化碳的能力等、特别是(3)要学会用关系式法解题从而减少运算量.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
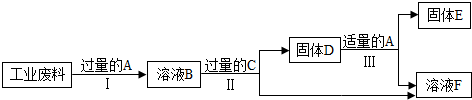
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向氢氧化钠固体中加入水 | 氢氧化钠固体消失 | 氢氧化钠与水发生了化学反应 |
| B | 用导管分别对准浸没在热水和冷水中的白磷通氧气 | 热水中的白磷燃烧, 冷水中的白磷不燃烧 | 燃烧条件之一是温度达到着火点 |
| C | 向溶质的质量分数为5%的过氧化氢溶液中加入少量氧化铜 | 有大量气泡产生 | 氧化铜起催化作用 |
| D | 向盐酸和氢氧化钙反应后的溶液中滴加酚酞 | 无明显现象 | 说明盐酸和氢氧化钙恰好反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com