
2017年1月9日,国务院将国家最高科学技术奖授予赵忠贤院士与屠呦呦研究员两位科学家。我国科学家屠呦呦因发现用于治疗疟疾的药物——青蒿素 (化学式为C15H2205),因而获得2015年诺贝尔生理学及医学奖。下列关于青蒿素的叙述错误的是( )

A. 青蒿素属于有机物
B. 青蒿素的相对分子质量为282g
C. 青蒿素的一个分子中含有45个原子
D. 青蒿素中碳元素的质量分数约为63.8%
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:初中化学 来源: 题型:选择题
| A. | 鉴别羊毛与涤纶,用灼烧的方法 | |
| B. | 冰与干冰,取样观察在常温下冰变为液体 | |
| C. | 酒精和白醋,用闻气味的方法鉴别 | |
| D. | 鉴别二氧化锰和碳粉,观察颜色即可 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 选取的试剂 | 实验现象 | 实验结论 |
| 稀盐酸 | 出现红棕色气体 | 该溶液为NaNO2溶液 |
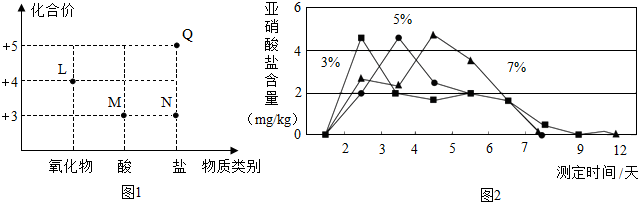
查看答案和解析>>
科目:初中化学 来源:2017届湖南省永州市祁阳县九年级第二次模拟考试理科综合化学试卷(解析版) 题型:选择题
下列有关生活事件中,从物质变化的角度分析,主要体现化学变化的是( )
A. 浯溪碑林雕刻 B. 用葡萄酿酒
C. 羊角塘鞭炮爆炸 D. 铁杵磨成针
查看答案和解析>>
科目:初中化学 来源:2017届湖南永州市祁阳县九年级第二次模拟考试化学试卷(解析版) 题型:选择填充题
我们日常生活中处处有化学,下列各自的做法正确的是( )
A. 农村老人家常常食用变质变霉的食物
B. 小胖用灼烧方法来鉴别合成纤维和羊毛纤维
C. 明明认为用活性炭可以将硬水软化
D. 一天红红家燃气灶用不起,她用打火机检查她家天然气管道是否通畅
查看答案和解析>>
科目:初中化学 来源:2017届江苏省兴化市顾庄学区三校九年级中考二模化学试卷(解析版) 题型:探究题
在溶液中较难制得纯净的Fe(OH)2,原因是Fe(OH)2不稳定,在水中只要有一点氧气就极易反应生成红褐色沉淀Fe(OH)3。写出其反应的化学方程式:
。
用下面两种精心设计的方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含氧气的蒸馏水配置FeSO4溶液与NaOH溶液,然后反应制备。

a.除去蒸馏水中溶解的氧气,常采用 的方法。
b.如图所示,用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。试管中油层的作用是 。
方法二:用如图装置来制备。

a在装置Ι中加入Fe和稀H2SO4,写出其反应的化学方程式 ;在装置Ⅱ中加入NaOH浓溶液。
b为了制得白色Fe(OH)2沉淀,需要下列步骤,其顺序为
①气密性检查 ②气体验纯
③加入试剂塞紧橡皮塞 ④打开止水夹 ⑤夹紧止水夹。
c.写出试管Ⅱ中发生的化学反应方程式
、 。
这样生成的Fe(OH)2沉淀能较长时间保持白色。
查看答案和解析>>
科目:初中化学 来源:2017届江苏省兴化市顾庄学区三校九年级中考二模化学试卷(解析版) 题型:选择填充题
如图,一木块漂浮于X中,向X中缓缓加入(或通入)少量物质Y后最终木块上浮,则X与Y可能是(溶液的体积变化忽略不计)
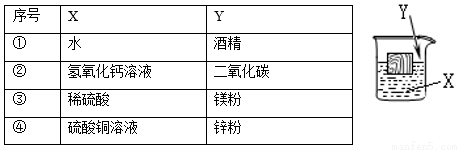
A. ①②④ B. ③④ C. ①②③ D. ②③④
查看答案和解析>>
科目:初中化学 来源:2017届广东省汕头市金平区九年级教学质量监测化学试卷(解析版) 题型:简答题
同学们完成实验后留下的废液中含有K2CO3、KCl和Na2SO4三种物质,在老师的指导下,化学小组的同学设计以下流程回收KCl晶体。
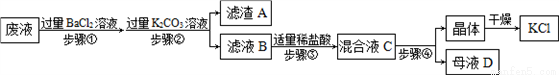
请回答:
(1)步骤①反应的化学方程式____________________、______________________。
(2)步骤②加入过量K2CO3溶液的目的是____________________________________;滤液B中的溶质是_______________、_____________、_______________(写化学式)。
(3)步骤③判断盐酸适量的现象是_________________________________________。
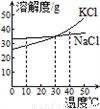
(4)混合液C中的溶质是KCl和NaCl,观察溶解度曲线,步骤④所包含的具体操作是______、降温结晶、过滤。降温结晶的最佳温度范围是________℃以下,晶体表面的杂质最好用______________________进行洗涤。
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
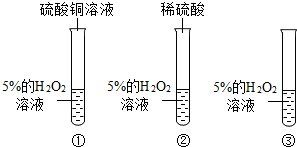
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com