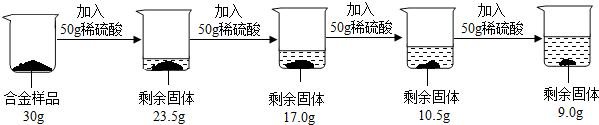
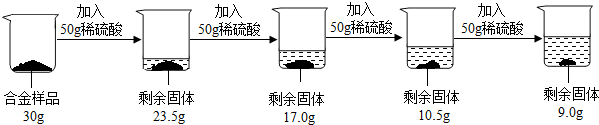
解:(1)由图中信息可以知道,在前三次加入稀硫酸时,固体质量均减少6.5g,但是第四次加入稀硫酸固体质量只减少了1.5g,说明第四次中稀硫酸有剩余,所以固体中铜的质量为9.0g,所以铜的质量分数为:
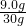
×100%=30%;
(2)6.5g金属和50g稀硫酸恰好完全反应,其中硫酸的质量为:50g×19.6%=镁和锌在发生置换反应时都生成+2价的硫酸盐,故设金属的相对原子质量为X,则:
M+H
2SO
4═MSO
4 +H
2↑
X 98
6.5g 9.8g
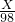
=
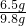
解得:X=65,
所以该金属为锌;
(3)第三次加入稀硫酸充分反应后,生成硫酸锌的质量为y,氢气的质量为z,则:
Zn+H
2SO
4═ZnSO
4+H
2↑
98 161 2
9.8g×3 y z
=29.4g
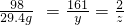
解得:y=48.3g,z=0.6g;
所得溶液中溶质的质量分数为:
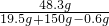
×100%=28.6%.
答:第三次加入稀硫酸充分反应后,所得溶液中溶质的质量分数为28.6%.
故答案为:(1)30%;(2)锌;(3)28.6%.
分析:(1)由图中信息可以知道,在前三次加入稀硫酸时,固体质量均减少6.5g,但是第四次加入稀硫酸固体质量只减少了1.5g,说明第四次中稀硫酸有剩余,所以固体中铜的质量为9.0g,可以据此求算出铜的质量分数;
(2)由(1)的分析可以知道,6.5g金属和50g稀硫酸恰好完全反应,可以据此结合+2价的金属与酸反应的化学方程式,判断出金属种类;
(3)根据判断出的金属,写出化学方程式,求算出所生成的硫酸盐,然后结合溶质的质量分数的计算公式即可求算出反应后所得溶液中溶质的质量分数.
点评:要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景或图表信息等,结合所学的相关知识和技能,细致地分析题意(或图表信息)等各种信息资源,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.

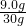 ×100%=30%;
×100%=30%;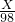 =
=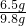
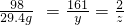
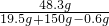 ×100%=28.6%.
×100%=28.6%.

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案