
【题目】为了从电路板的废腐蚀液(含有CuCl2、FeCl2和FeCl3)中回收铜,并重新得到FeCl3溶液,设计如下实验流程。(已知:2FeCl3+Fe=3FeCl2)
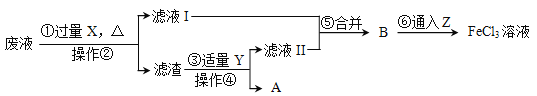
(1)操作②的名称是___________。
(2)上述流程中,X的化学式是______,加入X需过量的原因是____________________。步骤③中发生反应的化学方程式是____________,其基本反应类型是__________。
(3)Z为Cl2,第⑥步发生的反应为化合反应,此反应的化学方程式是________________。
科目:初中化学 来源: 题型:
【题目】我国制碱工业先驱侯德榜发明了“侯氏制碱法”。其模拟流程如下:
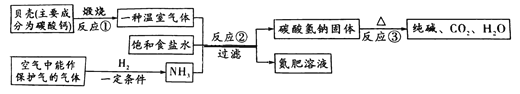
下列有关化学方程式的书写及基本反应类型不正确的是
A. 反应①:CaCO3![]() CaO+CO2↑ 分解反应
CaO+CO2↑ 分解反应
B. 合成NH3:N2+3H2![]() 2NH3 化合反应
2NH3 化合反应
C. 反应③:2NaHCO3![]() Na2CO3+H2O+CO2↑ 分解反应
Na2CO3+H2O+CO2↑ 分解反应
D. 反应②:CO2+NaCl+H2O+NH3=NaHCO3↓+NH4Cl 复分解反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一种自生氧防毒面具,其使用的生氧剂的主要成分是KO2。某研究小组取100 g生氧剂放入装置A中,加入足量水使之充分反应(4KO2+2H2O=4KOH+3O2↑),测定反应前后装置A的总质量。他们进行了三次实验,测定结果如下:
测定序号 | 第1次 | 第2次 | 第3次 | 平均值 |
反应前装置A总质量(g) | 400.1 | 400.2 | 399.7 | 400.0 |
反应后装置A总质量(g) | 376.1 | 376.1 | 375.8 | 376.0 |
请根据上述实验结果计算:(假设杂质不含钾元素且不与水反应)
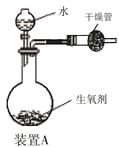
(1)100 g 生氧剂与水反应生成的氧气质量;
(2)生氧剂中含钾元素的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
(1)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,如图中能表示NaOH溶解度曲线的是__________(填“A”或“B”)。
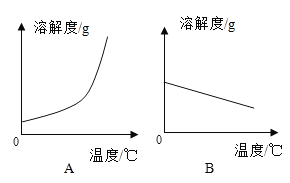
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,可采取措施有__________(填序号)。
①蒸发水;②升高温度;③降低温度;④加入水;⑤加入氢氧化钙。
(3)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后恢复20℃,得到乙溶液,溶液中溶质的质量分数的关系为甲________乙(填“>”、“<”或“=”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】α-丙氨酸是合成蛋白质的基础物质之一,其分子结构如右图所示。下列有关该物质的说法不正确的是
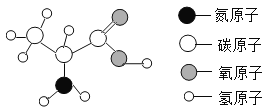
A. 从分类角度看:α-丙氨酸属于有机物
B. 从量的角度看:在α-丙氨酸中碳、氢、氧、氮各元素的原子个数比为3:7:2:1
C. 从变化角度看:α-丙氨酸全燃烧后的产物是二氧化碳和水
D. 从微观角度看:α-丙氨酸是由分子构成
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化钙(CaO2)为白色或淡黄色结晶粉末,是一种用途广泛的优良供氧剂,可用于鱼类养殖、农作物载培、污水处理等多方面。工业上可用大理石作原料制备过氧化钙,某校课外活动小组同学模拟工业过程制备过氧化钙样品并测量其纯度。
[查阅资料]①过氧化钙固体难溶于水,加热至315℃时开始分解,完全分解的温度为400~425℃。
②常温下过氧化钙干燥且很稳定。过氧化钙能溶于稀酸生成过氧化氢,过氧化钙在湿空气或水中会逐渐缓慢地分解,长时间放出氧气。
[实验一]提纯碳酸钙
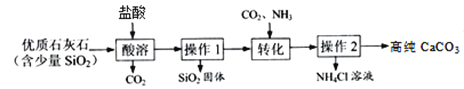
已知:“转化”步骤中的反应方程式为:CaCl2 + NH3 + CO2 + H2O = CaCO3↓ + 2NH4Cl
(1)酸溶过程中发生反应的化学方程式是___________________________________。
(2)过程中的生成物可直接应用于流程的是_______________。
[实验二]过氧化钙的制备:
已知:①CaCl2 + H2O2 + 2NH3·H2O + 6H2O=CaO2·8H2O + 2NH4Cl;
②CaO2·8H2O不溶于水,在0℃时稳定,加热至130℃时逐渐变为无水CaO2。

(3)为控制沉淀的温度为0℃左右,在实验室宜采取的方法为_____________________。
(4)操作A在实验室常用的步骤有_____________、降温结晶、过滤、洗涤、干燥,此操作中洗涤晶体时不可选用的洗涤剂为____________(用序号填空)。
a.冰水 b.40℃热水 c.饱和NH4Cl溶液
(5)最后烘干得到过氧化钙时,适宜的温度范围为_____________。
(6)已知产品的产率=![]() ,则此制备流程中CaO2的产率为__________。(写出计算过程,结果保留一位小数,2分)。
,则此制备流程中CaO2的产率为__________。(写出计算过程,结果保留一位小数,2分)。
(7)实验室现有溶质质量分数为37%、密度是1.18g·mL-1的浓盐酸,则配制12%的稀盐酸100g,需要水____________mL(水的密度是1g·mL-1,计算结果保留一位小数)。
[实验三]过氧化钙含量的测定
该活动小组设计下列装置,通过测定生成O2的体积,计算样品中CaO2的质量分数。
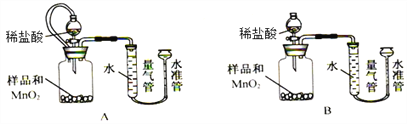
已知:a.CaO2 + 2HCl = CaCl2 + H2O2 b.杂质不与盐酸反应生成气体
(8)实验中MnO2的作用是____________________。
(9)相同条件下,_______________能使测定结果更准确(填“装置A”或“装置B”), 检查该装置气密性的操作是____________________________________。另一套装置测定结果不准确的主要原因是________________________________。
[观察生活]
(10)为防止过氧化钙在空气中变质,应____________保存。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为a、b、c三种固体物质的溶解度曲线。
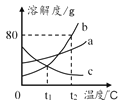
(1)t2℃时,三种物质溶解度的大小顺序是_____。
(2)t1℃时,将等质量的b、c两物质加水溶解配制成饱和溶液,所得溶液的质量大小关系为mb_____mc(填“>”“<”或“=”)
(3)t2℃时,将55g b加入50g水中充分溶解,所得溶液的质量为_____g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文。
谈到农药,人们可能想到它对人体健康和环境的危害,其实农药在农业生产上起着重要的作用。目前市售蔬菜农药残留量虽然已达到国家标准,但通过科学的清洗方法仍可进一步降低农药残留。
实验人员分别选取含甲、乙农药的蔬菜,研究了不同清洗方法对农药去除率的影响。
清水浸泡。图 1 呈现出两种农药的去除率随浸泡时间的变化。
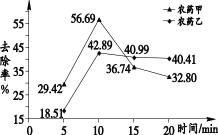
洗洁精清洗。实验选择了 6 种洗洁精进行测试,结果表明,多数洗洁精对农药的去除率可达到 60%以上,最高可达到 84%。
碱性溶液浸泡。食用碱(Na2CO3 和 NaHCO3) 溶液有利于农药分解。图2表示不同浓度的食用碱溶液对农药去除率的影响。
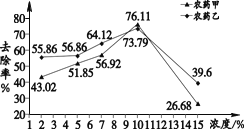
希望同学们可以选择科学的清洗方法,更加安全的食用蔬菜。依据文章内容,回答下列问题。
(1)依据图 1 分析,去除农药残留的最佳浸泡时间是________ min。
(2)NaHCO3 的组成元素中,非金属元素有________种。
(3)食用碱溶液的 pH________ 7(填“>”、“=”或“<”)。
(4)用食用碱溶液浸泡含有农药甲的蔬菜时,要想超过清水浸泡的最大去除率,可以选取的浓度是________(填序号,下同)。
A 2% B 8% C 10% D 15%
(5)下列说法正确的是________。
A 采用清水浸泡去除农药的时间不宜过长
B 多数洗洁精对农药的清洗效果比清水浸泡的好
C 食用碱的去除效果较好,是因为在浸泡过程中农药发生了化学变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com