
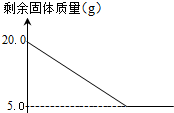
 某兴趣小组的同学为测定某石灰石中碳酸钙(假设:石灰石中的杂质不与盐酸反应)的质量分数,称取一定质量的石灰石置于烧杯中,用某浓度的稀盐酸100g,分5次加入,每次充分反应后,取出固体,经过滤、洗涤、干燥等操作后称重,各次稀盐酸用量和剩余固体质量记录如下:
某兴趣小组的同学为测定某石灰石中碳酸钙(假设:石灰石中的杂质不与盐酸反应)的质量分数,称取一定质量的石灰石置于烧杯中,用某浓度的稀盐酸100g,分5次加入,每次充分反应后,取出固体,经过滤、洗涤、干燥等操作后称重,各次稀盐酸用量和剩余固体质量记录如下:| 实验次数 | 稀盐酸的用量(g) | 剩余固体的质量(g) |
| ① | 20 | 16.25 |
| ② | 40 | 12.50 |
| ③ | 60 | m |
| ④ | 80 | 5.00 |
| ⑤ | 100 | n |
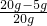 ×100%=75%.
×100%=75%.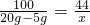


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:阅读理解
| 商品 | 食用纯碱 | 食用小苏打 | 快速发酵粉 |
| 成分 | 碳酸钠 | 碳酸氢钠 | 碳酸氢钠,有机酸 |

| 温度 溶解度 盐 |
10℃ | 20℃ | 30℃ | 40℃ |
| NaCO3 | 12.5g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
查看答案和解析>>
科目:初中化学 来源: 题型:
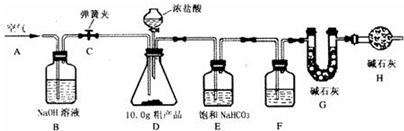
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 测定时间 | 5:05 | 5:10 | 5:15 | 5:20 | 5:25 | 5:30 | 5:35 |
| PH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |
| 现象 | 结论 |
| ①如果沉淀没有溶解 | 则猜想 II II 正确 |
| ②如果沉淀全部溶解,并放出有刺激性气味的气体 | 则猜想 I I 正确 |
| ③如果 沉淀部分溶解且放出有刺激性气味气体 沉淀部分溶解且放出有刺激性气味气体 |
则猜想III正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 结论 |
| 稀盐酸与氢氧化钠溶液反应放热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com