
 ×100%
×100%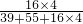
 ═6500mL
═6500mL K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑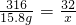 ,
,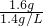 =1.143L
=1.143L

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:初中化学 来源: 题型:
| O的相对原子质量 |
| KMnO4的相对分子质量 |
| 16×4 |
| 39+55+16×4 |
查看答案和解析>>
科目:初中化学 来源:吴中区二模 题型:问答题
| O的相对原子质量 |
| KMnO4的相对分子质量 |
| 16×4 |
| 39+55+16×4 |
查看答案和解析>>
科目:初中化学 来源: 题型:
解决问题常面临着方法的选择,面对不同的结果我们应继续探索。为得知15.8g高锰酸钾完全分解能产生多少克氧气,小柯与小妍分别采取了以下方法:
| 小柯:实验测定法 | 小妍:计算法 |
| 小柯在老师的指导下,将15.8g高锰酸钾充分加热,得到氧气1300ml. | 解:高锰酸钾中氧元素的质量分数 O的相对原子×4 = ——————————×100% KMnO4的相对分子质量 16×4 = ——————————×100%=40.5% 39+55+16×4 氧气的质量为:15.8g×40.5%=6.40g 答:15.8个高锰酸钾完全分解产生氧气6.4g. |
请回答:
⑴在本实验条件下,氧气的密度为1.4×10-3g/mL,则由小柯的测量结果可算出15.8g高锰酸钾分解后所产生的氧气质量为 g.
⑵大家经过讨论,认为小妍的计算方法明显错误,此题不能采用该方法计算氧气质量的一项理由是 。
A.高锰酸钾中含氧元素
B.锰酸钾和二氧化锰中含氧元素
C.氧气中含氧元素
⑶请计算15.8g高锰酸钾完全分解所产生的氧气质量。
⑷若实验操作无误,不考虑实验中的误差,针对小柯的测定结果与你的计算结果,请提出一种合理的猜测: 。
查看答案和解析>>
科目:初中化学 来源:2010年江苏省苏州市吴中区中考化学二模试卷(12月)(解析版) 题型:解答题
 ×100%
×100%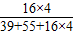
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com