
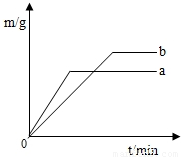
 (2002?宁德)硫酸铜溶液可以使锌与稀硫酸的反应变快.在a、b两份稀硫酸(足量)中各加入等质量的锌粒,其中一份还滴入少量的硫酸铜溶液,反应过程生成的H2质量(m)与时间(t)的关系如右图,试回答:
(2002?宁德)硫酸铜溶液可以使锌与稀硫酸的反应变快.在a、b两份稀硫酸(足量)中各加入等质量的锌粒,其中一份还滴入少量的硫酸铜溶液,反应过程生成的H2质量(m)与时间(t)的关系如右图,试回答: 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:初中化学 来源:2002年福建省宁德市中考化学试卷(解析版) 题型:填空题
 2CuO+2SO2,CuO+H2SO4=CuSO4+H2O
2CuO+2SO2,CuO+H2SO4=CuSO4+H2O查看答案和解析>>
科目:初中化学 来源:专题突破训练_化学新课标活题测试卷12(解析版) 题型:填空题
 2CuO+2SO2,CuO+H2SO4=CuSO4+H2O
2CuO+2SO2,CuO+H2SO4=CuSO4+H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com