
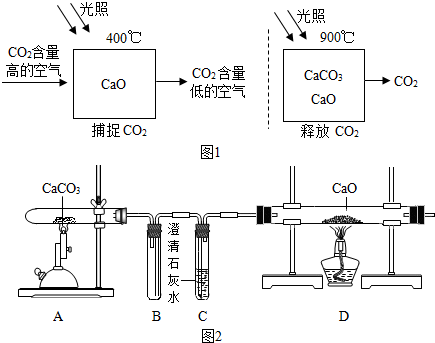
分析 根据二氧化碳能使澄清石灰水变浑浊进行解答;根据二氧化碳和澄清石灰水反应后A装置内的压强变小进行解答;根据碳酸钙能与盐酸反应生成二氧化碳气体进行解答;根据反应的原料及反应的条件分析.
解答 解:(1)二氧化碳能使澄清石灰水变浑浊,所以能证明“释放CO2”的现象是C中的澄清石灰水变浑浊;
(2)二氧化碳和澄清石灰水反应后A装置内的压强变小,所以装置B的作用是防止石灰水倒吸入装置A中热的试管内(炸裂瓶底);
(3)氧化钙若是捕捉二氧化碳则会生成碳酸钙,检验碳酸钙需要加入稀盐酸;
(4)若是捕捉二氧化则生成碳酸钙,碳酸钙与盐酸反应生成气体.
(5)还想探究的问题是二氧化碳的捕捉效率hi多少;
故答案为:
(1)C中澄清石灰水变浑浊,CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(2)防止C中石灰水倒吸炸裂玻璃管
(3)取D中反应后固体于试管中,滴加稀盐酸;
(4)有气泡产生
(5)该捕捉过程中二氧化碳的捕捉效率是多少.
点评 本题属于信息题,考查了有关二氧化碳、氧化钙、氢氧化钙、碳酸钙等的性质和用途,难度不大,依据已有的知识结合题目的信息分析即可.


科目:初中化学 来源: 题型:解答题
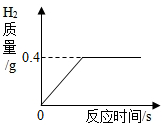 现有一块质量为20克的铜锌合金,将它投入到100克稀硫酸中恰好完全反应,放出气体的质量与反应时间的关系如图所示,试计算:
现有一块质量为20克的铜锌合金,将它投入到100克稀硫酸中恰好完全反应,放出气体的质量与反应时间的关系如图所示,试计算:查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 方案一节约能源 | B. | 方案二铜的利用率较低 | ||
| C. | 方案一不产生污染大气的二氧化硫 | D. | 方案二硫酸的利用率较低 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
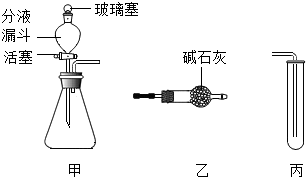 将图所示甲、乙、丙装置进行不同的组合,可以完成不同的实验,其中涉及的物质为初中化学常见物质.(提示:碱石灰的主要成分是CaO和NaOH)
将图所示甲、乙、丙装置进行不同的组合,可以完成不同的实验,其中涉及的物质为初中化学常见物质.(提示:碱石灰的主要成分是CaO和NaOH)查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com