
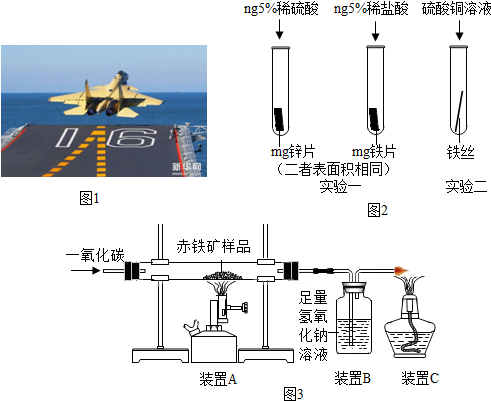
分析 (1)根据铁生锈的条件解答;铁锈的主要成分是氧化铁,它能与稀盐酸反应生成氯化铁和水;
(2)①从控制变量的角度进行分析;②若铁的活动性强于铜,则铁可置换出硫酸铜中的铜.
(3)①一氧化碳在高温下还原氧化铁生成铁和二氧化碳;②由于氧化铁与一氧化碳反应生成了铁和二氧化碳,只要测出反应后还原反应器中药品的质量,就可计算出反应前后减少的质量,减少的质量就是氧化铁中氧的质量,从而计算出氧化铁的质量,进而计算出氧化铁的质量分数;或测出反应前后二氧化碳吸收瓶增加的质量,即生成的二氧化碳的质量,根据二氧化碳的质量再计算出氧化铁的质量,进而计算出氧化铁的质量分数.
解答 解:(1)钢铁的锈蚀,实际上是铁跟水和氧气共同作用的结果;
铁锈的主要成分是氧化铁,它能与稀盐酸反应生成氯化铁和水,反应方程式为:Fe2O3+6HCl=2FeCl3+3H2O;
(2)①从图可以看出选取的酸的种类不同,因此以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱不够合理;故答案为:选取的酸的种类不同;
②实验二中,若铁丝表面出现红色物质,溶液由蓝色变成浅绿色,可证明铁的活动性强于铜,该反应的化学方程式为Fe+CuSO4═FeSO4+Cu,属于置换反应;
(3)①一氧化碳在高温下还原氧化铁生成铁和二氧化碳,装置A中生成铁的反应的化学方程式是:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
②由于氧化铁与一氧化碳反应生成了铁和二氧化碳,只要测出反应后还原反应器中药品的质量,就可计算出反应前后减少的质量,减少的质量就是氧化铁中氧的质量,从而计算出氧化铁的质量,进而计算出氧化铁的质量分数;或测出反应前后装置B增加的质量,即生成的二氧化碳的质量,根据二氧化碳的质量再计算出氧化铁的质量,进而计算出氧化铁的质量分数.所以,要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是还原反应器在反应前后的质量变化或二氧化碳吸收瓶在反应前后的质量变化.
故答案为:
(1)氧气、水蒸气,Fe2O3+6HCl=2FeCl3+3H2O;
(2)①选取的酸的种类不同;②铁丝表面出现红色物质;Fe+CuSO4═FeSO4+Cu;置换.
(3)①Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;②反应后还原反应器中药品的质量.
点评 本题难度不大,综合性较强.掌握常见合金、钢铁锈蚀的原理和除锈原理是解决本题的关键.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 探究步骤 | 对实验的观察和描述 |
| 点燃前 | 石蜡放入水中观察到的现象 石蜡漂在水面上. |
| 燃着时 | ①点燃蜡烛,把一根火柴梗放在蜡烛的火焰中,如图所示,约1s后取出可以看到火柴梗的a(选填图中字母)处最先炭化,说明此处温度最高. ②干冷的烧杯内壁出现水珠现象,澄清的石灰水变浑浊.  |
| 熄灭后 | 吹灭蜡烛,观察到一缕白烟. |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | Cu(NO3)2溶液 | AgNO3 | 加入适量的铁粉,过滤 |
| B | KNO3溶液 | Ba(NO3)2 | 滴加过量K2SO4溶液、过滤 |
| C | CO2气体 | CO气体 | 点燃 |
| D | NaCl固体 | 泥沙 | 加水溶解、过滤、蒸发 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
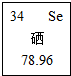 2015年我省固镇县富硒黑花生又喜获丰收,平均亩产达到350公斤.硒是人体必需的14种营养元素之一,与贫血症、冠心病、不孕症、癌症等疾病直接相关,因此,被誉为“生命的奇效元素”.下列关于硒元素的说法中错误的是( )
2015年我省固镇县富硒黑花生又喜获丰收,平均亩产达到350公斤.硒是人体必需的14种营养元素之一,与贫血症、冠心病、不孕症、癌症等疾病直接相关,因此,被誉为“生命的奇效元素”.下列关于硒元素的说法中错误的是( )| A. | 该元素的原子核外电子数为34 | B. | 该元素为非金属元素 | ||
| C. | 该元素的相对原子质量为78.96g | D. | 该元素的原子序数为34 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 事实 | 解释 |
| A | 物体的热胀冷缩 | 分子大小随温度改变而改变 |
| B | 50mL酒精与50mL水混合后体积小于100mL | 分子之间有一定间隔 |
| C | 衣柜中的“樟脑球”过一段时间会变小甚至消失 | 分子在不断的运动 |
| D | 一氧化碳气体能燃烧,二氧化碳气体不能燃烧 | 不同种分子性质不相同 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 铁制品镑蚀条件的探究实验中:
铁制品镑蚀条件的探究实验中:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com