
【题目】高纯氧化铁可作现代电子工业的材料。以下是以硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程图。
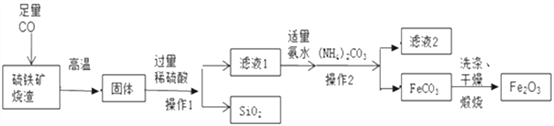
(1)实验室中,操作1、操作2用到的玻璃仪器有玻璃棒、烧杯、_____等。
(2)滤液1中主要的阳离子是 ______________。(写2种)
(3)滤液1中加氨水要适量,若氨水不足,则硫酸不能完全反应;若氨水过量,则__________________。
(4)滤液2中可回收的产品是____________(写化学式)。
(5)写出在空气中煅烧FeCO3的化学反应方程式______________________________
【答案】 漏斗 Fe2+、H+ 会生成Fe(OH)2(或Fe(OH)3) (NH4)2SO4 4FeCO3+O2![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
【解析】(1)据图可以看出,经过操作Ⅰ、操作Ⅱ得到的是滤液和固体,故是过滤操作,用到的玻璃仪器有玻璃棒、烧杯、漏斗;
(2)一氧化碳能将氧化铁还原为铁,将氧化亚铁还原为铁,故硫铁矿高温通入一氧化碳得到的固体中主要含有的是铁,稀硫酸能与铁反应生成硫酸亚铁和氢气,故含有亚铁离子,由于硫酸过量,故含有氢离子,滤液Ⅰ中主要的阳离子是亚铁离子和氢离子,化学符号为:Fe2+、H+;
(3)由于硫酸过量,溶液呈酸性,氨水呈碱性,若氨水过量,会生成Fe(OH)2或Fe(OH)3;
(4)碳酸铵能与硫酸亚铁反应生成碳酸亚铁和硫酸铵,故滤液Ⅱ中可回收的产品是硫酸铵,化学式为:(NH4)2SO4;
(5)在空气中煅烧FeCO3生成氧化铁和二氧化碳,反应的化学方程式是:4FeCO3+O2![]() 2Fe2O3+4CO2。
2Fe2O3+4CO2。


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】电解水实验的说法错误的是

A. 水电解成H2和O2的分子数比为2:1,根据原子守恒推出水分子中H、O原子数比为2:1
B. 反应一段时间后,a、b玻璃管中产生的气体质量比约为8:1
C. 负极产生的气体使带火星木条复燃,正极产生的气体能被点燃
D. 由电解水实验得出结论:水是由氢、氧两种元素组成的
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组设计了如图所示的微型实验。
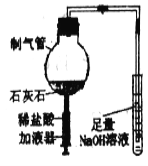
(1)在制气管中加入石灰石,推压加液器活塞加入适量稀盐酸,请用化学方程式表示其反应原理。
(2)当制气管中的反应停止后,试管中溶液倒吸进制气管中,产生白色沉淀,请解释产生上述现象可能的原因。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文。
鸡蛋营养价值很高,一个重约50 g的鸡蛋,约含7 g蛋白质。蛋黄中富含卵磷脂,卵磷脂可以阻止胆固醇和脂肪在血管壁上沉积,被称为“血管清道夫”。一般人群每天吃1~2个鸡蛋不会造成血管硬化,但多吃会增加肝、肾负担。
鸡蛋不宜生食,也不建议吃溏心鸡蛋。因为生鸡蛋中含有抗营养因素,会影响营养素的利用,还可能被沙门氏菌污染。烹调鸡蛋达到70~80℃才能杀灭沙门氏菌,当蛋黄凝固时说明温度已接近。所以最好是蛋黄刚凝固时起锅,烹调时间过长会降低鸡蛋的营养价值。
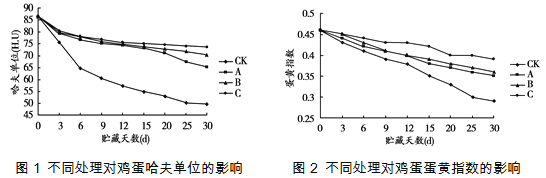
市售鸡蛋常采用三种涂膜保鲜技术,分别是:A-聚乙烯醇溶液涂膜、B-聚乙烯醇和双乙酸钠溶液涂膜、C-聚乙烯醇和氢氧化钙溶液涂膜。三种涂膜剂涂抹于鸡蛋表面后,在温度为20℃、相对湿度为70%的贮藏柜中贮藏30天,测得哈夫单位和蛋黄指数的变化趋势如下图所示,其中CK是对照组,哈夫单位和蛋黄指数的数值越小,鸡蛋越不新鲜。
鸡蛋买回家后,在-1℃、相对湿度80%的条件下储存,最长可以保鲜6个月。
依据文章内容回答下列问题:
(1)每100 g鸡蛋,约含蛋白质______g。
(2) C-聚乙烯醇和氢氧化钙溶液涂膜保鲜鸡蛋的过程中,发生反应的化学方程式为___________。
(3)三种涂膜保鲜技术中,保鲜效果最好的是_________________。
(4)在进行涂膜保鲜效果的研究中使用了_________方法。
(5)下列说法正确的是_______。
①鸡蛋营养价值高,每天可以多吃
②鸡蛋煮的时间越长越好,有利于杀灭细菌
③生吃鸡蛋、吃溏心蛋和不吃蛋黄,是不科学的做法
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据如图物质的溶解度曲线,判断下列说法正确的是

A. 将乙的饱和溶液过滤,能得到不饱和溶液
B. t1℃时,甲溶液、乙溶液的溶质质量相等
C. t2℃185g甲溶液降温至t1℃时,能析出49g晶体
D. 将26%的甲溶液从t2℃降温到t1℃时,溶质质量分数不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“细菌冶金”的原理是利用氧化铁硫杆菌促使黄铁矿(主要成分FeS2)氧化成硫酸铁和硫酸,并为CO2和H2O合成有机物提供能量,流程如下图。下列说法错误的是 ( )
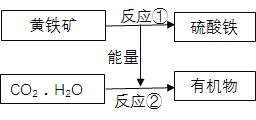
A. 氧化铁硫杆菌在反应①中起催化作用
B. 整个流程提高了能量的利用率
C. 图中有机物可能含碳、氢、氧元素
D. 反应①化学方程式:4FeS2+15O2+2X=2Fe2(SO4)3+2H2SO4,X为H2O2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】镁在航空航天领域有广泛应用,刚刚首飞的C919客机上大量应用了含镁材料。镁元素的相关信息如图所示。请回答下列问题:
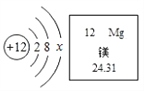
(1)镁原子的质子数为________,x=_____________。
(2)镁属于____________元素(填“金属”或“非金属”),金属镁在化学反应在容易__________(填写“得到”或“失去”)电子。
(3)海水中含有丰富的氯化镁,目前工业上绝大多数的金属镁是从海水中提取的,其生产流程如图:
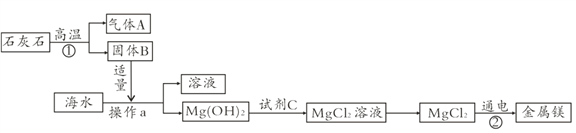
在上述流程中,操作a的名称是____,反应②的化学方程式为________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(9分)某研究性学习小组在验证“碱使酚酞试液变红”的实验时,发现一个意外现象:将酚酞试液滴入某NaOH溶液中,溶液变成了红色,可是过一会儿红色却消失。
【提出问题】是什么原因导致滴有酚酞的NaOH溶液由红色褪为无色?
【猜想与假设】他们分别对这种意外现象作如下猜想:
甲同学:可能是酚酞与O2发生了反应;
乙同学:可能是NaOH溶液与空气中的CO2发生了反应;
丙同学:可能与 大小有关;
【设计实验】三位同学分别设计实验验证自己的猜想:
(1)甲同学设计了如下实验,请你填写下表。
实验步骤 | 设计这一步骤的目的 | 实验现象 | 实验结论 |
①将NaOH溶液加热煮沸 | ① | 溶液变红,过一会儿红色消失 | 甲同学猜想___________(填“正确”或不正确”)新课 |
②向冷却后的溶液中滴人酚酞,并滴一些植物油在其上方 | ② |
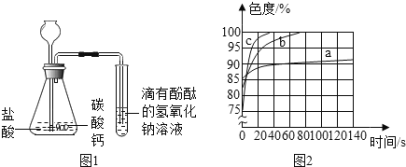
(2)乙同学设计如图一装置进行实验,一段时间后,试管中溶液的红色褪去,于是认定自己的猜想正确。写出CO2与NaOH溶液反应的化学方程式: 。
甲同学认为乙同学的实验不够严谨,理由是: 。
(3)丙同学使用了色度传感器测溶液的颜色。他在a、b、c三个比色皿中分别加入等量5%、10%、20%的NaOH溶液,然后各滴加2滴酚酞试液。溶液颜色的变化曲线如图[说明:溶液无色时色度值(透过率)为100%]。请你观察图二写出规律性结论:_____________________ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸铜是一种应用极其广泛的化工原料,易溶于水而不易溶于酒精;铜离子完全沉淀的pH是5左右,铁离子完全沉淀的pH是2左右。以下是某工厂用含铁废铜为原料生产胆矾(CuSO4·5H2O)和副产物石膏(CaSO4·2H2O)的生产流程示意图:

胆矾和石膏在不同温度下的溶解度(g/100g水)如表。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
(1)红褐色滤渣的主要成分是____________;
(2)铜和稀硝酸反应的化学方程式3Cu+8HNO3=_____________+2NO↑+4H2O;
(3)石灰浆调pH大约要调节到___________
A. 2 B. 5 C. 7 D. 10
(4)操作I最后温度应该控制在___________℃左右;
(5)从溶液中分离出硫酸铜晶体的操作Ⅱ应为蒸发浓缩、_______、过滤、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com