
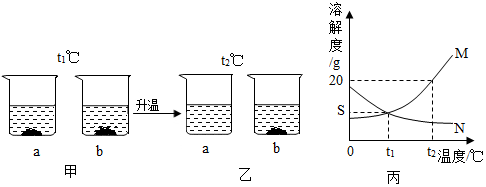
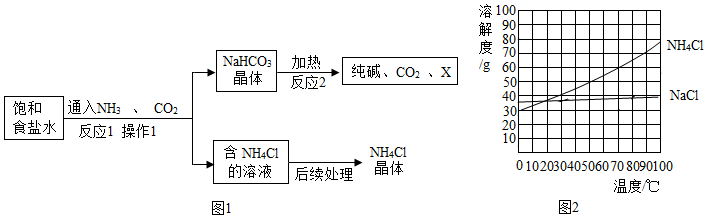
分析 (1)氨盐水显碱性,容易吸收二氧化碳;
过滤能够把固体和液体分离;
NaHCO3结晶析出后,剩余溶液仍然是碳酸氢钠的饱和溶液;
反应后氯化钠被消耗,剩余溶液是氯化钠的不饱和溶液;
(2)化学反应遵循质量守恒定律,即反应前后元素种类不变,原子种类、总个数都不变;
(3)根据实验过程及其物质的溶解度曲线可以判断相关方面的问题.
解答 解:(1)A、向饱和食盐水中先通入氨气,使溶液呈碱性,更易吸收酸性的CO2气体,该选项说法正确;
B、反应后,NaHCO3首先结晶析出,过滤即可将其分离出来,该选项说法正确;
C、NaHCO3结晶析出后,剩余溶液中的溶质至少有碳酸氢钠和氯化铵,该选项说法不正确;
D、反应后氯化钠被消耗,剩余溶液是氯化钠的不饱和溶液,剩余溶液还能继续溶解NaCl固体,该选项说法正确.
故选:C.
(2)由2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2A+Cl2↑+H2↑可知,反应前后氯原子都是2个,反应前钠原子是2个,反应后应该是2个,包含在2A中,反应前氢原子是4个,反应后应该是4个,其中2个包含在2A中,反应前氧原子是2个,反应后应该是2个,包含在2A中,因此A的化学式为NaOH.
故填:NaOH.
(3)①从t1℃到t2℃的变化过程中,一直处于饱和状态的是b溶液,这是因为b中始终由未溶解的固体.
故填:b.
②丙图中,曲线M表示的是a的溶解度曲线,这是因为随着温度升高,a中固体消失,说明a的溶解度随着温度升高而增大.
③若a中混有少量b,可采用降温结晶的方法提纯a.
故填:降温结晶.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
| 加入盐酸质量(g) | 20 | 40 | 60 | 80 | 100 | 120 |
| 收集的气体质量(g) | 0.88 | a | 2.64 | 3.52 | 4.4 | 4.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 红磷在氧气中能燃烧,在空气中不能燃烧 | |
| B. | 铁丝在空气中燃烧时,火星四射,生成黑色固体 | |
| C. | 硫在氧气中燃烧后生成有刺激性气味的气体 | |
| D. | 木炭伸入盛有氧气的集气瓶中剧烈燃烧,发出白光 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com