实验课上老师让同学们配制一定溶质质量分数的氯化钙溶液.药品柜中可供选择的药品只有氢氧化钙、氧化钙、碳酸钙和硝酸钙四种固体及一定溶质质量分数的稀盐酸.同学们交流讨论后,选择一种固体药品并称取15g加入烧杯中,再向其中加入105.4g稀盐酸.充分反应后过滤,得到5g固体和111g氯化钙溶液(实验中损耗不计).并将上述配好的氯化钙溶液倒入贴有相应标签的试剂瓶中,请回答下列问题:
(1)同学们选择的固体药品的化学式是________;
(2)题中发生反应的化学方程式________;
(3)请根据已知条件列出求解生成氯化钙质量(x)的比例式:________;
(4)试剂瓶标签上氯化钙溶液的溶质质量分数为________.
解:(1)因为只有CaCO
3与HCl反应生成CO
2气体,其它均不生成气体或沉淀.故同学们选择的固体药品是碳酸钙,化学式为CaCO
3;
(2)碳酸钙与盐酸反应的化学方程式为 CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;
(3)生成的CO
2质量为105.4+15-5-111=4.4(克),由于没有完全反应,所以参加反应的碳酸钙的质量为15-5=10(克).
设生成氯化钙质量为x
CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑
100 111 44
15g-5g x 4.4
∴生成氯化钙质量(x)的比例式为

=
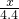
或

=

;
(4)据(3)可知
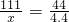
解之得x=11.1
氯化钙溶液的溶质质量分数为
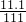
×100%=10%
答:试剂瓶标签上氯化钙溶液的溶质质量分数为10%.
分析:(1)要配制一定溶质质量分数的氯化钙溶液,在所给药品中,应选用与盐酸反应有明显现象的药品;
(2)同学们选择的固体药品是碳酸钙,它与盐酸反应的化学方程式为CaCO
3+HCl=CaCl
2+H
2O+CO
2↑;
(3)根据化学方程式,可以得到各物质间的比例关系,据此写出生成氯化钙质量(x)的比例式;
(4)根据化学方程式,可以得到各物质间的比例关系,根据

×100%,可以求出氯化钙溶液的溶质质量分数.
点评:本题需要学生熟悉氢氧化钙、氧化钙、碳酸钙和硝酸钙四种固体药品与盐酸发生反应的现象,才能正确选择;同时,学生要熟练掌握溶质质量分数的计算方法,才能得出比例式,进而求出溶质质量分数.

 =
=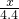 或
或 =
= ;
;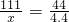
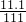 ×100%=10%
×100%=10% ×100%,可以求出氯化钙溶液的溶质质量分数.
×100%,可以求出氯化钙溶液的溶质质量分数.

 (2007?吉林)在化学实验课上,老师让同学们完成分组实验:自己设计实验方案证明氢氧化钠与稀盐酸恰好完全反应.下面是来自不同小组的三位同学的实验过程,请你帮助他们分析、解决实验过程中遇到的问题.
(2007?吉林)在化学实验课上,老师让同学们完成分组实验:自己设计实验方案证明氢氧化钠与稀盐酸恰好完全反应.下面是来自不同小组的三位同学的实验过程,请你帮助他们分析、解决实验过程中遇到的问题.