
科目:初中化学 来源: 题型:选择题
| 物质 | W | P | Q | R |
| 反应前物质质量/g | 6.4 | 3.2 | 4.0 | 0.5 |
| 反应后物质质量/g | 待测 | 2.56 | 7.2 | 0.5 |
| A. | 变化后待测的W质量为3.84 g | |
| B. | Q物质中含有的元素种类是W、P、R三种物质中所有元素种类之和 | |
| C. | 该变化的反应类型是化合反应 | |
| D. | P物质可能是单质 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 实验室用H2还原CuO得到红色固体Cu,但其中是否含有Cu2O(红色),某研究性学习小组进行了认真的探究
实验室用H2还原CuO得到红色固体Cu,但其中是否含有Cu2O(红色),某研究性学习小组进行了认真的探究查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CO2 | B. | Fe2O3 | C. | Mg | D. | NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
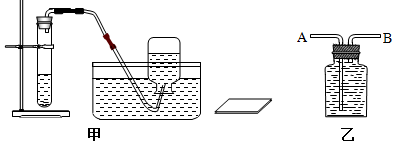
 利用如图测定空气中氧气的含量,写出该实验中发生的化学方程式为2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO你所看到的现象:铜丝逐渐变黑,实验测得空气中氧气的含量为19.2%,请分析该实验出现的误差的原因是铜丝的量不足等(举例一种)
利用如图测定空气中氧气的含量,写出该实验中发生的化学方程式为2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO你所看到的现象:铜丝逐渐变黑,实验测得空气中氧气的含量为19.2%,请分析该实验出现的误差的原因是铜丝的量不足等(举例一种)查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 某纯碱样品中经检测含有氯化钠杂质.为测定产品中碳酸钠的质量分数,在20℃的室温下,称取该产品样品45g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液.用精密仪器测得反应过程中烧杯内混合物的质量(m)变化,得到与反应时间(t)关系如图所示.求:
某纯碱样品中经检测含有氯化钠杂质.为测定产品中碳酸钠的质量分数,在20℃的室温下,称取该产品样品45g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液.用精密仪器测得反应过程中烧杯内混合物的质量(m)变化,得到与反应时间(t)关系如图所示.求:查看答案和解析>>
科目:初中化学 来源:【全国区级联考】江苏省盐城市亭湖区2017届九年级毕业班下学期第二次质量检测化学试卷 题型:信息分析题
金属是重要的资源。
⑴ 铜制品在空气中会发生锈蚀[铜锈的主要成分是Cu2(OH)2CO3]。某化学兴趣小组欲通过实验探究“铜生锈是否需要空气中的二氧化碳?”如图所示实验中(试管内的“ ”均为铜片),只需完成实验_____即可达到探究目的(填字母组合)。
”均为铜片),只需完成实验_____即可达到探究目的(填字母组合)。

⑵ 铁是世界上年产量第一的金属。工业上用一氧化碳和赤铁矿炼铁的化学方程式是________,得到的生铁可炼成钢。
⑶ 铝是地壳中含量最多的金属元素。
①用坩埚钳夹住一小块铝箔,在酒精灯上加热至熔化,轻轻晃动,观察到熔化的铝被一层膜兜着并不滴落,产生该现象的原因是__________________________。
②铝和氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O=== 2NaAlO2+3H2↑,足量的稀盐酸与氢氧化钠溶液分别和等质量的铝粉充分反应,产生氢气的质量分别为m1、m2,下列有关m1、m2大小关系的说法正确的是____(填字母)。
A.m1>m2 B.m1<m2 C.m1=m2 D.无法比较
⑷ 验证Cu、Fe、Al金属的活动性强弱,下列的实际组合实验方案不能达到实验目的是_____。
A.FeSO4溶液、Al、Cu B.Al2(SO4)3溶液、稀盐酸溶液、Fe、Cu
C.Al2(SO4)3溶液、FeSO4溶液、Cu D.AlCl3溶液、CuCl2溶液、Fe
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
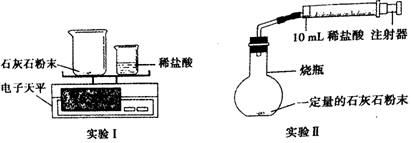
| 时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 注射器读数/ml | 60.0 | 85.0 | 88.0 | 89.0 | 89.5 | 89.8 | 89.9 | 90.0 | 90.0 | 90.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com