
| 实验操作 | 实验现象 | 实验结论 |
| Ⅰ.取少量黑色产物加入到装有足量FeCl3溶液的烧杯中,充分反应后过滤,对过滤所得固体用蒸馏水洗涤. | 黑色固体部分溶解 | 猜想2和4都不成立 |
| Ⅱ.取少量黑色产物加入到装有足量稀盐酸的烧杯中,充分反应后,向溶液中滴加KSCN溶液 | 黑色固体全部溶解,溶液不变红色 | |
| Ⅲ.另取少量黑色产物装入玻璃管中,通入CO,一段时间后加热,并将反应后的气体通入装有一定量的澄清石灰水的烧杯中. | 澄清石灰水变浑浊 | 猜想1不成立 猜想3成立 |
分析 (1)四氧化三铁和稀盐酸反应生成氯化铁、氯化亚铁和水;
(2)猜想1:Fe;猜想2:Fe和Fe3O4;猜想3:Fe和FeO;猜想4:Fe、Fe3O4、FeO;
铁和稀盐酸反应生成氯化亚铁和氢气,氧化亚铁和稀盐酸反应生成氯化亚铁和水;
加热条件下,铁和一氧化碳不能反应,氧化亚铁和一氧化碳反应生成铁和二氧化碳,二氧化碳能使澄清石灰水变浑浊.
解答 解:(1)Fe3O4与盐酸反应的化学方程式为:Fe3O4+8HCl═2FeCl3+FeCl2+4H2O.
故填:Fe3O4+8HCl═2FeCl3+FeCl2+4H2O.
(2)猜想1:Fe;猜想2:Fe和Fe3O4;猜想3:Fe和FeO;猜想4:Fe、Fe3O4、FeO;
【实验探究】如下表所示:
| 实验操作 | 实验现象 | 实验结论 |
| Ⅰ.取少量黑色产物加入到装有足量FeCl3溶液的烧杯中,充分反应后过滤,对过滤所得固体用蒸馏水洗涤. | 黑色固体部分溶解 | 猜想2和4都不成立 |
| Ⅱ.取少量黑色产物加入到装有足量稀盐酸的烧杯中,充分反应后,向溶液中滴加KSCN溶液 | 黑色固体全部溶解,溶液不变红色 | |
| Ⅲ.另取少量黑色产物装入玻璃管中,通入CO,一段时间后加热,并将反应后的气体通入装有一定量的澄清石灰水的烧杯中. | 澄清石灰水变浑浊 | 猜想1不成立 猜想3成立 |
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 时间(S) | 0 | 20 | 30 | 40 | 60 | 80 | 100 | 120 |
| 硫酸溶液增加的质量(g) | 0 | 0.7 | 1.0 | 1.2 | 1.5 | 1.6 | 1.7 | 1.7 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质(括号内为杂质) | 试剂 | 操作方法 |
| A | CO2(CO) | 氧气 | 点燃 |
| B | KCl(K2SO4) | 蒸馏水和过量氯化钡溶液 | 溶解、过滤、蒸发 |
| C | NH3(H2O) | 足量的浓硫酸 | 洗气 |
| D | Cu(CuO) | 足量的稀硫酸 | 浸泡、过滤、洗涤、干燥 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| Fe(OH)3 | Al(OH)3 | Mg(OH)2 | |
| 开始沉淀时的pH | 1.5 | 3.3 | 10.4 |
| 沉淀完全时的pH | 3.2 | 5.2 | 12.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
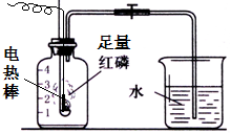 按如图组装仪器,关闭止水夹,通电使红磷燃烧.请回答下列问题:
按如图组装仪器,关闭止水夹,通电使红磷燃烧.请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 二氧化硫 | B. | 二氧化碳 | C. | 水蒸气 | D. | 氮气 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 地壳中含量最高的元素是铝 | B. | 人体中含量最高的元素是氢 | ||
| C. | 空气中含量最高的元素是氧 | D. | 海洋中含量最高的元素是氧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com