
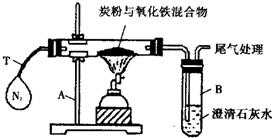
 16、14、某化学活动小组对过量炭粉与氧化铁反应中气体的成分进行研究.
16、14、某化学活动小组对过量炭粉与氧化铁反应中气体的成分进行研究.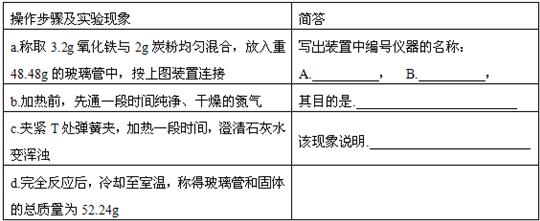
| 操作步骤及实验现象 | 简答 |
| 仪器的名称:A 铁架台;B 试管; | |
| 其目的是:排尽装置中的空气,避免氧气产生干扰. | |
| 该现象说明:木炭和氧化铁反应有二氧化碳气体生成. | |


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 加入氢氧化钠溶液的总质量/g | 20 | 40 | 60 | 80 | 140 | 160 |
| 生成沉淀的质量/g | 0 | 0 | 1.07 | 2.14 | 5.35 | 5.35 |
查看答案和解析>>
科目:初中化学 来源:2010-2011学年北京市朝阳区中考二模化学试卷(解析版) 题型:计算题
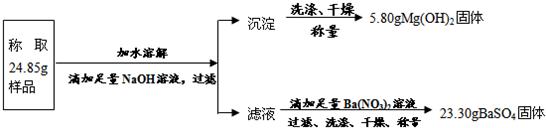
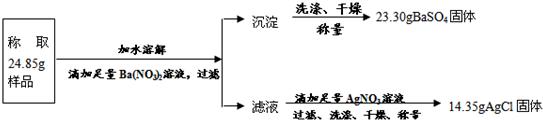
(3分)某化学活动小组用稀盐酸对赤铁矿中Fe2O3含量进行测定(杂质不与盐酸反应且不溶于水),得到一黄色残液。为防止直接排放造成环境污染,对其进行了处理,过滤该残液,取100 g 滤液,向其中不断加入某未知溶质质量分数的氢氧化钠溶液,所得
实验数据如下表:
|
加入氢氧化钠溶液的总质量/g |
20 |
40 |
60 |
80 |
140 |
160 |
|
生成沉淀的质量/g |
0 |
0 |
1.07 |
2.14 |
5.35 |
5.35 |
(资料:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl)
通过对上述实验数据的分析,选择合理的数据,计算所加氢氧化钠溶液中溶质的质量
分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com