
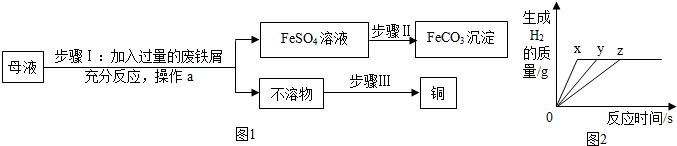
分析 (1)根据铁和硫酸铜反应生成硫酸亚铁和铜进行分析;
(2)根据质量守恒定律进行分析;
(3)根据铁锈和硫酸反应生成硫酸铁和水,硫酸铁和铁会生成硫酸亚铁进行分析;
(4)根据碳酸亚铁是沉淀,硫酸亚铁经过步骤Ⅱ生成了碳酸亚铁,所以该试剂可以是碳酸钠进行分析;
(5)根据不溶物中含有置换出的铜和反应剩余的铁进行分析;
(6)根据金属的活动性以及反应原理来分析.
解答 解:(1)溶液甲中含有硫酸铜,硫酸铜和加入的铁屑反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=Cu+FeSO4;故填:Fe+CuSO4=Cu+FeSO4;
(2)通过分析xFe2(SO4)3+yFe=zFeSO4可知,依据化合价的升降,将方程式配平,所以Fe2(SO4)3+2Fe=3FeSO4,z的值为3;故填:3;
(3)步骤Ⅰ中,废铁屑含有少量铁锈,对产物的成分没有影响,原因是铁锈与硫酸反应生成硫酸铁,硫酸铁和铁会生成硫酸亚铁;故填:3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;Fe2(SO4)3+Fe=3FeSO4;
(4)碳酸亚铁是沉淀,硫酸亚铁经过步骤Ⅱ生成了碳酸亚铁,所以该试剂可以是碳酸钠;故填:Na2CO3;
(5)通过推导可知,不溶物中含有置换出的铜和反应剩余的铁,所以步骤Ⅲ回收铜的方法为:加入过量的稀硫酸,过滤、洗涤、干燥.故填:H2SO4;
(6)因为镁最活泼,反应时间少,则图线X表示镁的反应情况,因为三种金属生成的氢气质量相等,结合生成的氢气质量=$\frac{金属的化合价}{金属的相对原子质量}$×金属质量,可知:锌可能反应完,镁、铁一定过量,故填:Mg;Mg、Fe.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中所给的知识进行解答.金属与酸反应的有关知识,综合性较强,不仅需要根据图象和题意分析出直接信息,还需要根据计算得出用量问题.


科目:初中化学 来源: 题型:解答题
 根据装置图回答下列问题:
根据装置图回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 10℃时,甲、乙两种物质的饱和溶液浓度相同 | |
| B. | 保持 20℃,蒸发溶剂可使接近饱和的乙溶液变成饱和溶液 | |
| C. | 30℃时,将 40g 甲物质加人 50g 水中,充分溶解后溶液的质量为 80g | |
| D. | 10℃时,将两种饱和溶液升温至 30℃,溶液中溶质的质量分数都增大 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 真空包装食品 | B. | 在沥青公路上晒粮食 | ||
| C. | 给橙子“打蜡上色” | D. | 用工业酒精勾兑饮用酒 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 喜家德水饺是中国水饺餐饮连锁企业的领导品牌.喜家德秉承中华美食传统,结合现代健康饮食理念,精选上好食材,为顾客提供真材实料、现包现煮的美味健康水饺.目前遍布全国40多座城市,拥有连锁店面300多家,员工4000多人,已成为全国具影响力的专业水饺连锁领导品牌,请回答下列问题:
喜家德水饺是中国水饺餐饮连锁企业的领导品牌.喜家德秉承中华美食传统,结合现代健康饮食理念,精选上好食材,为顾客提供真材实料、现包现煮的美味健康水饺.目前遍布全国40多座城市,拥有连锁店面300多家,员工4000多人,已成为全国具影响力的专业水饺连锁领导品牌,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com