
| A. | ZnCl2 | B. | AlCl3 | C. | MgCl2 | D. | FeCl3 |
科目:初中化学 来源: 题型:选择题
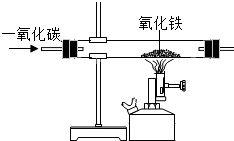 如图是“一氧化碳与氧化铁反应”的部分实验装置,关于该实验说法正确的是( )
如图是“一氧化碳与氧化铁反应”的部分实验装置,关于该实验说法正确的是( )| A. | 该实验的反应原理是FeO+CO$\frac{\underline{\;高温\;}}{\;}$ Fe+CO2 | |
| B. | 在实验过程中,黑色的粉末会逐渐变成红色 | |
| C. | 充分反应后,向固体中加稀盐酸会产生气泡 | |
| D. | 在实验过程中,产生的尾气可以直接排放到空气中 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
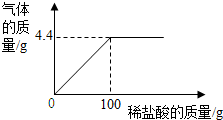 为测量Na2CO3和NaCl组成的样品中NaCl的质量分数,取15g该固体样品,全部溶于200mL水中,向所得到的混合溶液中逐滴滴入溶质质量分数为7.3%的稀盐酸,记录了如图所示的曲线关系.(水的密度为1g/mL,质量分数计算结果精确到0.1%)
为测量Na2CO3和NaCl组成的样品中NaCl的质量分数,取15g该固体样品,全部溶于200mL水中,向所得到的混合溶液中逐滴滴入溶质质量分数为7.3%的稀盐酸,记录了如图所示的曲线关系.(水的密度为1g/mL,质量分数计算结果精确到0.1%)查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 气体发生装置内物质的总质量(g) | |
| 反应前 | 35.6 |
| 反应后 | 34.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 试管 | A | B | C | D |
| 镁条长度 | 1cm | 2cm | 3cm | 4cm |
| 不溶物 | 无 | 少量 | 较多 | 很多 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
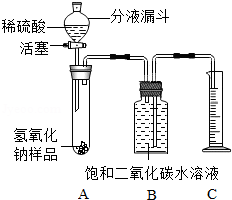 某化学课外小组的同学,为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已经略去),实验在27℃,101kPa下进行.
某化学课外小组的同学,为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已经略去),实验在27℃,101kPa下进行.| 实验步骤 | 实验现象 | 实验结论 |
| 1取样,溶于水,滴加过量的氯化钙溶液 | 产生白色沉淀 | 氢氧化钠部分变质 |
| 2静置,向上层清液中滴加酚酞溶液 | 变红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com