
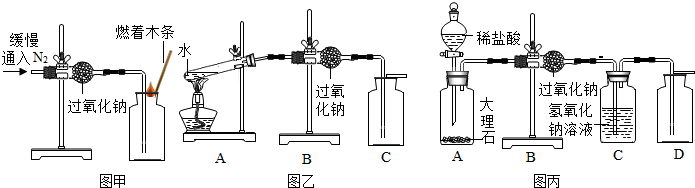
| 实验操作 | 主要实验现象 | 实验结论及解释 | |
| ① | 检查装置的气密性. 向装置中加入药品. | \ | 装置的气密性良好. |
| ② | 打开分液漏斗活塞,向A装置中缓慢加入稀盐酸. | A装置中观察到的现象有有气泡冒出,固体逐渐减少. | A装置中发生反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑. |
| ③ | 一段时间后用带火星的木条在D内进行检验. | 带火星的木条复燃. | 过氧化钠与二氧化碳反应并生成氧气. |
分析 【进行实验】实验Ⅰ:(2)如果过氧化钠与氮气发生反应生成氧气,则燃着的木头燃烧更旺;
实验Ⅱ:(1)根据题意判断;根据是否有无新物质生成判断物质的变化;
实验Ⅲ:(2)②大理石和稀盐酸反应生成二氧化碳气体判断反应现象;
【实验反思】根据生成的二氧化碳中混有水蒸气,而水蒸气与过氧化钠反应也生成氧气进行解答;
解答 解:【进行实验】实验Ⅰ:(2)如果过氧化钠与氮气发生反应生成氧气,则燃着的木头燃烧更旺,如没反应,则燃着的木条熄灭,故填:燃着木条熄灭
实验Ⅱ:(1)由题意知,A装置是把水加热至沸腾产生水蒸气,所以A装置的作用是提供水蒸气,故填:提供水蒸气;
(2)过氧化钠与水蒸气发生反应并生成氧气.实验中这种验证氧气的方法是利用了氧气支持燃烧的性质;
实验Ⅲ:(2)②大理石和稀盐酸反应生成氯化钙、水和二氧化碳,所以反应现象是有气泡产生,同时大理石逐渐减小;C装置作用是除去没反应掉的二氧化碳,能收集到较纯的氧气.故填:有气泡冒出,固体逐渐减少;CaCO3+2HCl=CaCl2+H2O+CO2↑;除去二氧化碳
【实验反思】因为生成的二氧化碳中混有水蒸气,而水蒸气与过氧化钠反应也生成氧气,故应先干燥二氧化碳,在和过氧化钠反应,故填:二氧化碳中混有水蒸气,而水蒸气与过氧化钠反应也生成氧气.
故本题答案为:
【进行实验】实验Ⅰ:(2)燃着木条熄灭;
实验Ⅱ:(1)提供水蒸气;(2)支持燃烧的;
实验Ⅲ:(2)
| 实验操作 | 主要实验现象 | 实验结论及解释 | |
| ① | 检查装置的气密性. 向装置中加入药品. | \ | 装置的气密性良好. |
| ② | 打开分液漏斗活塞,向A装置中缓慢加入稀盐酸. | A装置中观察到的现象有 有气泡冒出,固体逐渐减少. | A装置中发生反应的化学方程式为 CaCO3+2HCl=CaCl2+H2O+CO2↑. |
| ③ | 一段时间后用带火星的木条在D内进行检验. | 带火星的木条复燃. | 过氧化钠与二氧化碳反应并生成氧气. |
点评 本题考查了过氧化钠与二氧化碳的反应及其反应产物氧气和碳酸钠的检验,完成此题,可以依据题干提供的信息以及已有的知识进行.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 测定溶液的PH时,将试纸直接放入待测液中 | |
| B. | 将固体药品直接放在天平的托盘上称量 | |
| C. | 不慎将浓碱溶液沾到皮肤上,立即用大量水冲洗,再涂上硫酸 | |
| D. | 实验室用CO还原氧化铁时,先通CO,再点燃加热氧化铁的酒精喷灯 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题


查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 夏天,鱼塘中的鱼常常会浮在水面呼吸 | |
| B. | 烧开水时,沸腾前水中有气泡产生 | |
| C. | 打开“七喜”饮料瓶盖会有大量气泡冒出 | |
| D. | 喝了汽水以后,常常会打嗝 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
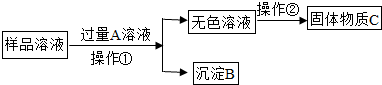
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com