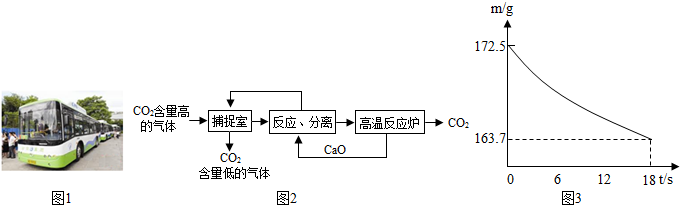
(2012?浦口区二模)“低碳城市”的理念贯穿在上海世博园的建设中
(1)“低碳城市”的建设减少了二氧化碳气体的排放,能减缓
温室效应
温室效应
的程度;自然界中消耗二氧化碳的主要途径是
光合作用
光合作用
;请你写出一种日常生活中符合“低碳经济”理念的做法:
随手关灯,废物利用
随手关灯,废物利用
.
(2)法国化学家PaulSabatier采用“组合转化”技术使CO
2和H
2在催化剂作用下生成CH
4和H
2O.试写出该反应的化学方程式
.
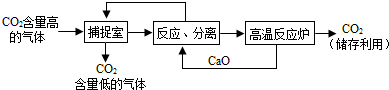
(3)近来有科学家提出利用“碳捕捉技术”来降低工业生产中二氧化碳的排放量.“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO
2分离出来进行储存和利用.常利用足量的NaOH溶液来“捕捉”CO
2,过程如图所示(部分条件及物质未标出).①捕捉室中发生反应的化学方程式为:
?CO2+2NaOH═Na2CO3+H2O
?CO2+2NaOH═Na2CO3+H2O
.
②把CaO放入反应分离室中与H
2O反应,请写出该反应的化学方程式:
CaO+H2O═Ca(OH)2
CaO+H2O═Ca(OH)2
;利用此反应,氧化钙可用作食品
干燥
干燥
剂.
③“反应分离”中,得到固体物质的基本操作是
过滤
过滤
,该固体是碳酸钙.
④整个过程中,可以循环利用的物质有
CaO、NaOH
CaO、NaOH
.
(4)取10g碳酸钙固体高温加热,一段时间后停止加热,测得剩余固体中钙元素的质量分数为50%,则下列判断正确的是
A
A
.
A.生成了2g二氧化碳
B.剩余固体质量为5g
C.生成了5.6g氧化钙
D.剩余碳酸钙的质量为8g.