宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂的过滤网,以除去所含的二氧化碳,化学方程式为2LiOH+CO2=Li2CO3+H2O.
(1)试计算吸收44g二氧化碳需要氢氧化锂的质量.
(2)若用氢氧化钠代替氢氧化锂,则吸收44g二氧化碳需要氢氧化钠的质量为______g.
(3)利用(1)和(2)所得结果,试解释宇宙飞船选用氢氧化锂来吸收二氧化碳比用氢氧化钠效果更好的原因:______.
(4)若每位宇航员每天所呼出的二氧化碳平均是502L,若4位宇航员进行一项为期7天的太空任务,试写出消耗氢氧化锂质量的计算式.(在宇宙飞船内的温度和气压下,二氧化碳气体的密度为1.833g/L).______.(友情提示:只须写出计算式,不必求出结果)
解:(1)设吸收44g二氧化碳需要氢氧化锂的质量为x
2LiOH+CO
2═Li
2CO
3+H
2O
48 44
x 44g
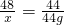
解得:x=48g;
答:吸收44 g二氧化碳需要氢氧化锂的质量为48 g.
(2)设吸收44g二氧化碳需要氢氧化钠的质量为y,则:
2NaOH+CO
2═Na
2CO
3+H
2O
80 44
y 44g
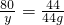
解得:y=80g;
答:吸收44g二氧化碳需要氢氧化钠的质量为80g;
(3)比较(1)和(2)的计算结果可以知道:吸收等质量二氧化碳需要氢氧化锂的质量少,这样可以减小飞船的载重;
(4)根据题意可以知道,宇航员共呼出的二氧化碳的质量为:502L×1.833g/L,结合(1)的计算可以知道需要氢氧化锂的计算式为:

故答案为:
(1)48g;
(2)80g;
(3)吸收等质量二氧化碳需要氢氧化锂的质量少,这样可以减小飞船的载重;
(4)

.
分析:(1)根据二氧化碳的质量结合化学方程式可以需要氢氧化锂的质量;
(2)根据二氧化碳的质量结合化学方程式可以求算出需要的氢氧化钠的质量;
(3)比较(1)和(2)的计算结果可以分析出原因;然后比较等质量的氢氧化锂和氢氧化钾所消耗二氧化碳的多少,就可以得到问题(3)的结论;
最后根据问题(1)的计算结果求出问题(4).
点评:本题主要考查学生运用化学方程式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

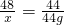
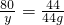

 .
.

 阅读快车系列答案
阅读快车系列答案