
| װ�ñ� | װ�ö� | |
| ��Ӧǰ | 48.8�� | 161.2�� |
| ��Ӧ�� | 46.5�� | 163.9�� |
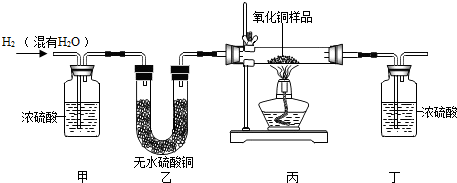
���� ��1������Ũ��������ʵ����ʲ����װ�÷��������ã�
��2������Ũ���������ˮ�ԣ����ӵ������������ɵ�ˮ������������Ϸ���ʽ�������ͭ�������������������Ʒ�е�����������
��3������ʵ��װ�ã���װ���������ͨ�������к���ˮ������Ũ���������ˮ�Խ��з������
��� �⣺��1����ʵ���У���װ�õ������dz�ˮ��
��2������Ũ�����������������������ɵ�ˮ����������������ˮ������Ϊ��163.9g-161.2g=2.7g����Ҫ����2.7gˮ��Ҫ�μӷ�Ӧ������ͭ������ΪX��
H2+CuO$\frac{\underline{\;\;��\;\;}}{\;}$Cu+H2O
80 18
x 2.7g
$\frac{80}{x}=\frac{18}{2.7g}$
x=12g
��������ͭ������������$\frac{12g}{15g}$
��100%=80%
������ͭ��Ʒ�Ĵ���Ϊ80%��
��3������Ũ����������������������ƫ��ԭ����Ũ���������ͨ�ţ������˿����е�ˮ�֣�
�ʴ�Ϊ����1����ˮ����2��80%����3��B��
���� �������׳����ĵط��Ƕ�����������ͬ��ԭ��������˽�װ�õ��ص㼰���ʵ������ǽ��Ĺؼ���Ҫ����Ũ�������ˮ�ԣ��������������ɵ�ˮ���������е�ˮҲ�����ˣ�


 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
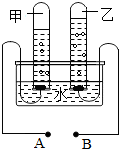 ��ͼ�ǵ��ˮ��ʵ��װ��ͼ������������˽��֪ʶ��գ�
��ͼ�ǵ��ˮ��ʵ��װ��ͼ������������˽��֪ʶ��գ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ô�����Һ��ȥˮ���е�ˮ�� | |
| B�� | ������Ʒ�ڸ���Ŀ����������� | |
| C�� | ����ͭ��������Ӿ��ˮ������Ҳ����������ˮ���� | |
| D�� | �þ���ϩ�����Ƴɵİ�װ���ɰ�װʳƷ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
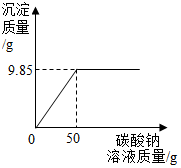 С��ͬѧ��ij�������������ʵ��������Ա��С��һ��������Ȼ������Ȼ�����ɵIJ�Ʒ���Ȼ��Ƶ�����������ȡ16.25g������Ʒ��ȫ������143.6gˮ�У������õ��Ļ����Һ����μ���������������Ϊ10.6%��̼������Һ����¼����ͼ��ʾ�����߹�ϵ������Ա��С�����ʾ����Ӧ�Ļ�ѧ����ʽBaCl2+Na2CO3�TBaCO3��+2NaCl
С��ͬѧ��ij�������������ʵ��������Ա��С��һ��������Ȼ������Ȼ�����ɵIJ�Ʒ���Ȼ��Ƶ�����������ȡ16.25g������Ʒ��ȫ������143.6gˮ�У������õ��Ļ����Һ����μ���������������Ϊ10.6%��̼������Һ����¼����ͼ��ʾ�����߹�ϵ������Ա��С�����ʾ����Ӧ�Ļ�ѧ����ʽBaCl2+Na2CO3�TBaCO3��+2NaCl�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com