
 化学实验探究是学习化学的重要方法.
化学实验探究是学习化学的重要方法.分析 (1)A、根据俯视视读数偏大,量取的实际体积偏小解答;
B、根据水和碱性溶液的pH判断;
C、根据测量空气中氧气含量时止水夹未加紧,实验中逸出了一部分气体,最终进入瓶内的水增多分析解答;
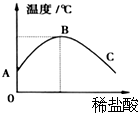
(2)①根据图象可以看出随着盐酸的加入温度在逐渐上升,据此进行分析解答;
②随着稀盐酸的滴加,溶液的碱性减弱,pH减小;
③C处的溶液中既有反应物,又有过量的稀盐酸;
④根据盐酸、氯化钠都能与硝酸银反应生成氯化银沉淀分析方案错误的原因.
(3)钠投入到氯化铁溶液中:钠和水反应生成氢氧化钠和氢气,溶液呈碱性,氢氧化钠和氯化铁反应生成红褐色沉淀氢氧化铁;
(4)氢氧化钠能和空气中的二氧化碳反应生成碳酸钠和水,碳酸钠能和稀盐酸反应生成氯化钠、水和二氧化碳;
根据反应前后的质量差可以计算生成二氧化碳的质量,根据二氧化碳的质量可以计算碳酸钠的质量,进一步可以计算样品中氢氧化钠的质量分数.
解答 解:
(1)A、量筒量取液体体积时俯视读数,导致索所取的水体积偏小,配制的溶液浓度偏高;
B、用水润湿后的pH试纸测定某碱性溶液的pH,相当于把碱性溶液稀释,其pH会变小;
C、测量空气中氧气含量时,若止水夹没有夹紧,则在压强差的作用下,导管口有气泡冒出;因实验中逸出了一部分气体,所以最终进入瓶内的水增多,导致测量结果偏大;
(2)①由图象可以看出,随着稀盐酸的加入,温度在逐渐的升高,说明稀盐酸与氢氧化钠溶液发生的反应是放热反应;
②稀盐酸和氢氧化钠反应生成氯化钠和水,反应的化学方程式为 HCl+NaOH═NaCl+H20.在B点前后温度是两种情况,B点温度最高,B点表示酸碱恰好完全反应;由图是可知,从A到B过程中,氢氧化钠逐渐减少,碱性减弱,故pH值逐渐减小;
③C处的溶质有反应后生成的氯化钠,还有过量的稀盐酸.
④由于NaCl与AgNO3反应也会产生白色沉淀,不能证明溶液中一定有HCl存在,所以实验方案错误.
(3)钠投入到FeCl3溶液中,发生反应为:2Na+2H2O═2NaOH+H2↑,3NaOH+FeCl3═Fe(OH)3↓+3NaCl,既有Na与H2O反应现象,又有NaOH与FeCl3反应现象.所以现象为:钠浮在液面上,与溶液剧烈反应,熔成小球,四处游动,发出嘶嘶声,有气泡冒出,有红褐色沉淀生成;
(4)生成二氧化碳的质量为:10g+50g--57.8g=2.2g,
设碳酸钠的质量为x,
Na2CO3+2HCl=2NaCl+H2O+CO2↑,
106 44
x 2.2g
$\frac{106}{x}=\frac{44}{2.2g}$
x=5.3g
样品中氢氧化钠的质量分数为:$\frac{10g-5.3g}{10g}×$100%=47%
答案:
(1)B;
(2)①放热;②减小(或变小);③NaCl、HCl;④由于NaCl与AgNO3反应也会产生白色沉淀,不能证明溶液中一定有HCl存在;
(3)有大量气泡生成,有红褐色沉淀生成;3NaOH+FeCl3═Fe(OH)3↓+3NaCl;
(4)样品中氢氧化钠的质量分数为47%.
点评 实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.


 综合自测系列答案
综合自测系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| OH- | CO32- | Cl- | SO42- | NO3- | |
| M2+ | 难溶 | 难溶 | 易溶 | 易溶 | 易溶 |
| A. | M+HCl | B. | MSO4+Ba(NO3)2 | C. | M(OH)2+NaCl | D. | MO+H2SO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
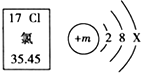
| A. | 图中m的值是17 | B. | 氯元素位于第三周期 | ||
| C. | 氯元素的相对原子质量为35.45 | D. | 在化学变化中,氯原子易失去电子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
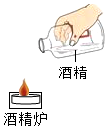 某饭店因服务员添加酒精操作错误而导致顾客被烧伤,调看事故录像发现,服务业拿起半瓶酒精,直接向仍有明火的酒精炉中添加酒精,火焰迅速蔓延至酒精槽内,瞬间从槽口喷出一条长长的火舌…
某饭店因服务员添加酒精操作错误而导致顾客被烧伤,调看事故录像发现,服务业拿起半瓶酒精,直接向仍有明火的酒精炉中添加酒精,火焰迅速蔓延至酒精槽内,瞬间从槽口喷出一条长长的火舌…查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com