


科目:初中化学 来源: 题型:阅读理解
| 实验方案 | 实验现象 | 结论 |
| ①取一定量的合金粉末,加过量的 30%氢氧化钠溶液 ,充分反应后过滤,滤渣备用. |
粉末部分溶解,并有气体放出 | 合金中一定含有 铝 |
| ②取步骤①所得滤渣,加过量的 10%盐酸 ,充分反应 |
滤渣又部分溶解也有气体放出. | 合金中一定含有 铁、铜 |
查看答案和解析>>
科目:初中化学 来源: 题型:
(2010?淮安)同学们为探究不同金属的活动性强弱,设计了如下的实验方案,下列方案中实验设计、现象、结论均正确的一组是
|
查看答案和解析>>
科目:初中化学 来源: 题型:

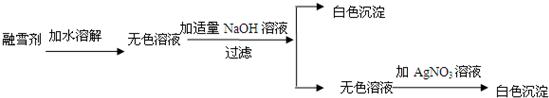
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 某化学小组利用如图所示装置测定铜锌合金样品中锌的质量分数(图中固定装置已略去)探究过程如下:
某化学小组利用如图所示装置测定铜锌合金样品中锌的质量分数(图中固定装置已略去)探究过程如下:查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 金属单质 | 铜 | 铝 | 锌 | 铁 | 铅 |
| 导电性(以银的导电性为100作标准) | 99 | 61 | 27 | 17 | 7.9 |
| 密度/(g?cm-3) | 8.92 | 2.70 | 7.14 | 7.86 | 11.3 |
| 熔点/℃ | 1083 | 660 | 419 | 1535 | 328 |
| 硬度(以金刚石的硬度为10作标准) | 2.5~3 | 2~2.9 | 2.5 | 4~5 | 1.5 |
| 实验步骤 | 观察到的现象 |
| ①在试管中取少量盐酸,插入铁丝,充分作用. | |
| ②在①所得的溶液中,插入 铜丝 铜丝 ,充分作用. |
无明显现象 |
| ③在②所得的溶液中插入 铝丝 铝丝 ,充分作用. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com