

| 加热 |
 ;故答案为:Na+
;故答案为:Na+ ;
;| 加热 |
| ||
| ||


科目:初中化学 来源: 题型:
| pH值范围 | 6.5-7.0 | 6.0-6.5 | 4.5-6.0 | 3.0-4.5 |
| 溪红点鲑 | √ | √ | × | × |
| 小口黑鲈 | √ | √ | × | × |
| 黑头呆鱼 | √ | × | × | × |
| 牛蛙胚胎 | √ | √ | √ | × |
| 小龙虾 | √ | √ | × | × |
| A、水体的pH值为3.0-4.5时,最适合这些生物生存 |
| B、该实验研究的是水体pH的变化对部分生物的影响 |
| C、上述生物中牛蛙胚胎在水体pH变化时存活范围最大 |
| D、水体pH发生变化可能是由于酸雨造成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 样品 | 第1份 | 第2份 | 第3份 | 第4份 | 第5份 |
| 取样品质量(g) | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 |
| 取稀硫酸质量(g) | 30.0 | 60.0 | 90.0 | 120.0 | 150.0 |
| 产生气体质量(g) | 0.3 | 0.6 | 0.9 | 1.0 | 1.0 |

查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
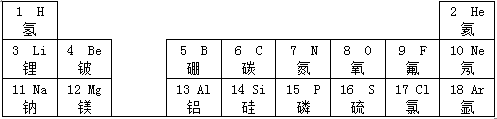
查看答案和解析>>
科目:初中化学 来源: 题型:
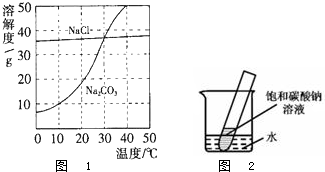
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验步骤 | 实验现象 | 实验结论 |
| 甲同学的猜想成立 |
| 化学方程式 | |
| 试剂1 | |
| 试剂2 |
查看答案和解析>>
科目:初中化学 来源: 题型:
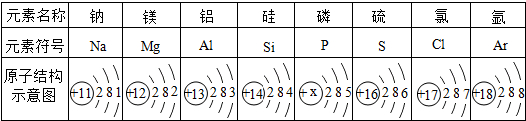
| ||
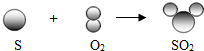
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com