
28. Cu��Fe��Al��A����Au�����������г��õĽ�����������ijѧϰС������⼸�ֽ�����ѧϰ������

������뽻�����ش��������⣺
(1)����ͬѧ�ڶ�������������ʱ�������ݽ�����ij�ֻ�ѧ������ͬ������Au��Cu��X������Ϊһ�࣬����ΪX�� ����������������� ��
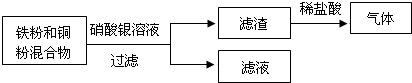
(2)����д������һ�ֽ�����AgNO3��Һ��Ӧ�Ļ�ѧ����ʽ ��
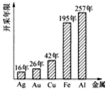
(3)����ͬѧ���ĵ��������ֽ������ܿ�������(���ݴ�������Ŀǰ�����ٶ�ȷ��)��ͳ������(����ͼ)����������ͼ�����һ��������Դ�������õĺ��������� ��
��4��������5�ֽ����У� �ǵؿ��к������Ľ���������ϡ���ᷴӦ�Ļ�ѧ����ʽ��
��
(1) A�� �������ڲ����ý���
(2) Cu + 2AgNO3 = Cu(NO3)2+ 2Ag (��������)
(3)������Ч�ؿ��ɽ�����Դ��������ò����շϾɽ�����(��������)
��4��Al 2Al+3H2SO4=Al2(SO4)3+3H2��
����������1��Cu��Fe��Al��Ag��Au�Ļ��˳��Ϊ��Al��Fe��H��Cu��Ag��Au����Au��Cu��X������Ϊһ�࣬���ͭ�������Ľ�������XҲ�����Ľ��������ʲ����ã�
��2����ǰ�Ľ������������������û���Ӧ�����û�������
��3��������Դ���ޣ�����Ҫ������Ч����Ҫ��Լʹ�ý�����Դ����˺������ɽ��������������÷Ͼɽ�����Ʒ��ʹ�ý�������Ʒ���DZ�Ҫ�Ĵ�ʩ��
��4���ؿ��к������Ľ��������������ᷴӦ��������������������


 �߲������Ӧ��һ��ͨϵ�д�
�߲������Ӧ��һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 28��Cu��Fe��Al��Ag��Au�����������г��õĽ�����������ijѧϰС������⼸�ֽ�����ѧϰ������������뽻�����ش��������⣺
28��Cu��Fe��Al��Ag��Au�����������г��õĽ�����������ijѧϰС������⼸�ֽ�����ѧϰ������������뽻�����ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 11��Cu��Fe��Al��A9��Au�����������г��õĽ�����������ijѧϰС������⼸�ֽ�����ѧϰ������������뽻�����ش��������⣺
11��Cu��Fe��Al��A9��Au�����������г��õĽ�����������ijѧϰС������⼸�ֽ�����ѧϰ������������뽻�����ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com