
早在西汉时期,我国就用铁与硫酸铜溶液反应制取铜,称为“湿法炼铜”。
(1)请写出“湿法炼铜”的化学方程式 。
(2)若用该方法制得铜32 g,反应的铁的质量为 g,若同时消耗了500 g硫酸铜溶液,则该硫酸铜溶液中硫酸铜的质量分数为 %。
科目:初中化学 来源: 题型:计算题
(4分)欲配制20g溶质质量分数10%的NaCl溶液。
(1)需要多少哪些原料? 、。
(2)已有天平(滤纸)、玻璃棒、药匙、试剂瓶,还必需哪些仪器? 、 。
查看答案和解析>>
科目:初中化学 来源: 题型:单选题
在CO、CO2混合气体中,氧元素的质量分数为64%。将该混合气体5g通过足量的灼热氧化铜,充分反应后,气体再全部通入足量的澄清石灰水中,得到白色沉淀的质量是
| A.5g | B.10g | C.15g | D.20g |
查看答案和解析>>
科目:初中化学 来源: 题型:单选题
在天平两边各放一只盛有等质量的相同溶质质量分数的稀硫酸的烧杯,把天平调至平衡,然后在左边烧杯中放入3.3克铝粉,为使天平平衡,向右边的烧杯中应加入镁粉的质量可能是( )
| A.6.6克 | B.3.3克 | C.3.2克 | D.2.4克 |
查看答案和解析>>
科目:初中化学 来源: 题型:单选题
煅烧石灰石可制得氧化钙(假设石灰石中的杂质不参与反应,且不含钙、碳元素).测得煅烧后剩余固体中钙元素与碳元素的质量比为20:3.则已分解的碳酸钙占原碳酸钙的质量分数为( )
| A.40% | B.60% | C.30% | D.50% |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
我国青海湖采集的天然碱样品可表示为aNa2CO3·bNaHCO3·cH2O(a、b、c为最简整数比)。小红同学为测定其组成,称取该天然碱样品16.6g进行如下实验: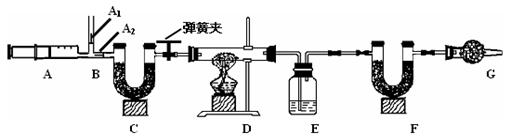
已知:1.碳酸钠比较稳定,加热时不分解 ;2. 2NaHCO3 Na2CO3 +CO2 ↑ +H2O
Na2CO3 +CO2 ↑ +H2O
3.图中B处为两个单向阀:推注射器时A1关闭,A2处打开;拉注射器时,A1打开进空气,A2关闭。
实验步骤
实验时,组装好装置,实验前应先 ,然后,实验步骤是:
① 反复推拉注射器 ② 称量E、F的质量 ③ 关闭弹簧夹,加热D处试管直到反
应不再进行 ④ 打开弹簧夹,再次反复缓缓推拉注射器 ⑤ 再次称量E、F的质量。
(二)问题探究:
(2) E中的药品为 ,E的作用是 。C、F、G中装有碱石灰(生石灰与烧碱的固体混合物),则C的作用是 , F的作用是 。写出 F装置中所发生反应的一个化学方程式 。
(3)实验步骤②与③能否颠倒 (填“能”或“不能”)。若不进行步骤④的操作,则所测得的碳酸氢钠质量 (填“偏大”、“偏小”、“无影响”), 该操作中推注射器时缓缓的目的是 ;若没有G装置,则碳酸氢钠的质量 (填“偏大”、“偏小”、“无影响”)。
(4)下表是实验记录数据:
| 反应前 | 反应后 |
| E的质量为100.0g | E的质量为102.25g |
| F的质量为50.0g | F的质量为51.1g |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
钙是维持人体正常功能所必需的元素。钙尔奇是常用的补钙剂,主要成分是CaCO3,钙尔奇每片2.0g。取1片钙尔奇,放入盛有10g稀盐酸的烧杯中,其中碳酸钙跟盐酸恰好完全反应(其它成分与盐酸不反应)。烧杯内物质质量变为11.34g。试计算:
(1)反应产生二氧化碳 g,是 mol;
(2)每片钙尔奇中含碳酸钙 mol;
(3)服用钙尔奇通常一日2次,每次1片。则每人每天摄入钙元素的质量为 g。
(4)根据化学方程式列式计算上述反应所用稀盐酸溶质的质量分数(精确到0.01%)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(5分) 55.7 g碳酸钠溶液恰好与36.5 g某盐酸溶液完全反应,测得反应后溶液的质量为90 g,求:
(1)生成了多少克二氧化碳?
(2)反应后所得溶液的溶质质量分数是多少?
(3)所用稀盐酸中溶质的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
重铬酸钾(K2Cr2O7Mr=294,铬元素为+6价,Mr表示相对分子质量)是一种重要的化工原料,在皮革工业、有机反应中都有广泛应用.但+6价格有很强的毒性易污染环境,使用后,须用绿矾,(FeSO4?7H2O,Mr=278)将其变成毒性+3价格才能做后续处理.反应原理是:6FeSO4?7H2O+K2Cr2O7+7H2SO4═3Fe2(SO4)3+Cr2(SO4)3+K2SO4+49H2O现有1.0吨重铬酸钾需要处理,计算需绿矾多少吨?(写出计算过程,结果精确到小数点后1位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com