
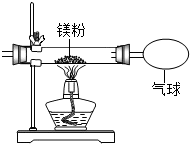
 某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.
某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.| 实验操作 | 实验现象及结论 |
| 取少量黄色固体于试管中,加入适量的水,并将湿润的红色石蕊试纸放在试管口 | 试管中有气体产生,湿润的红色石蕊试纸变蓝.证明猜想正确 |
| 实验序号 | 实验1 | 实验2 | 实验3 | / |
| 镁条反应的溶液 | NH4Cl | NaCl | Na2S04 | H20 |
| 实验现象 | 有大量气泡产生 | 有较多气泡产生 | 有少量气泡产生 | 气泡极少 |
| 加热后实验现象 | 气泡明显增多.可闻到氨味 | 气泡增多 | 气泡增多 | 气泡增多 |
分析 (1)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.
(2)根据氮气的化学性质进行分析.
(3)根据表格中实验的现象来分析解答.
解答 解:(1)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵循质量守恒定律.我不同意小明的观点,因为空气中的氧气和镁反应生成氧化镁.
(3)验证猜想如下表所示:
| 实验操作 | 实验现象及结论 |
| 把适量黄色固体置于试管中,加入适量的水,在试管口放湿润的红色石蕊试纸 | 实验现象:湿润的红色石蕊试纸变蓝; 实验结论:黄色固体是氮化镁 |
| 实验操作 | 实验现象及结论 |
| 取少量黄色固体于试管中,加入适量的水,并将湿润的红色石蕊试纸放在试管口 | 试管中有气体产生,湿润的红色石蕊试纸变蓝.证明猜想正确. |
点评 在应用质量守恒定律时,一定要分清反应物和生成物,不能忽略气体物质的质量.验证质量守恒定律,条件的控制是关键,一般用密闭容器进行实验,称量前后容器的质量变化.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某环保小组监测到一工厂向河水中排放的酸性废液中含有CuSO4.
某环保小组监测到一工厂向河水中排放的酸性废液中含有CuSO4.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 把浓硫酸注入盛有水的量筒内稀释 | B. | 用镊子取用块状固体药品 | ||
| C. | 将pH试纸浸入待测液中测定pH | D. | 将实验剩余的药品放回原试剂瓶中 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
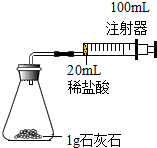 某化学实验小组对“影响石灰石与盐酸反应速率的因素-盐酸的浓度和石灰石的颗粒大小等”进行了如下实验探究,请你参与:
某化学实验小组对“影响石灰石与盐酸反应速率的因素-盐酸的浓度和石灰石的颗粒大小等”进行了如下实验探究,请你参与:| 实验编号 | 盐酸溶质质量分数(均取20ml) | 石灰石固体性质(均取1g) | 二氧化碳体积(ml)(均收集前30s的气体) |
| a | 4% | 颗粒 | 64.0 |
| b | 4% | 块状 | 40.4 |
| c | 6% | 颗粒 | 98.2 |
| d | 6% | 块状 | 65.3 |
| 时间/s | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 | 36 | 40 |
| 气体体积/ml | 16.0 | 22.2 | 29.4 | 39.3 | 50.4 | 57.6 | 62.0 | 64.7 | 66.0 | 66.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
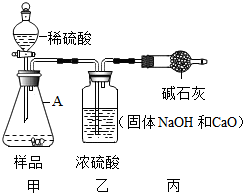 实验室贮存的烧碱易变质,围绕变质问题某学习小组同学取实验室放置了一段时间的烧碱固体样品进行下列探究,过程如下,请回答相关问题:
实验室贮存的烧碱易变质,围绕变质问题某学习小组同学取实验室放置了一段时间的烧碱固体样品进行下列探究,过程如下,请回答相关问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ①②④⑤ | C. | ①②③④ | D. | ①③④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com