
| A. | 用汽油除去衣服上的油渍 | B. | 用洗涤剂除去餐具上的油污 | ||
| C. | 用食醋除去水壶中的水垢 | D. | 用盐酸除去铁栏杆上的铁锈 |
 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:填空题
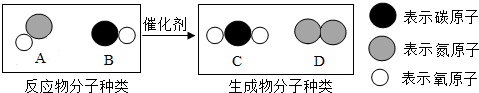
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 操作步骤 | 现象记录 | 反应的化学方程式 |
| 取两支试管,分别往试管中加入2mL样品,再往其中滴入盐酸 | 样品1:无明显现象 | NaOH+HCl=NaCl+H2O |
| 样品2:溶液中出现气泡 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ |
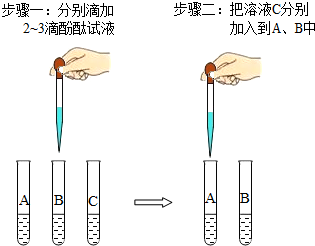
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
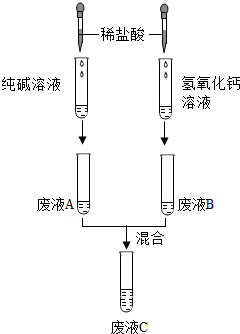 如下是小符同学在鉴别纯碱溶液和氢氧化钙溶液时所进行的系列实验:
如下是小符同学在鉴别纯碱溶液和氢氧化钙溶液时所进行的系列实验:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A物质的性质和用途 | B安全常识 |
| N2性质稳定--填充食品袋防腐 生石灰易吸水--用作食品干燥剂 酒精具有可燃性--可作燃料 | 居室装修--常开窗通风,使有害物挥发 油锅着火--盖上锅盖 煤气泄漏--关闭气阀、严禁烟火 |
| C元素与人体健康 | D日常生活经验 |
| 缺铁--易引起贫血 缺钙--易得甲状腺肿大 缺碘--易得骨质疏松 | 焙制糕点、蒸馒--常加入发酵粉 除水壶中水垢--常用食醋 检验淀粉---使用碘酒 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 先偏向左边,最后平衡 | B. | 先偏向左边,最后偏向右边 | ||
| C. | 一直平衡 | D. | 先偏向右边,最后偏向左边 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
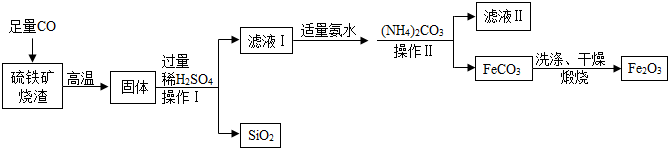
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com