
【题目】实验是科学探究的重要途径。
(1)结合下列化学实验装置,回答有关问题。
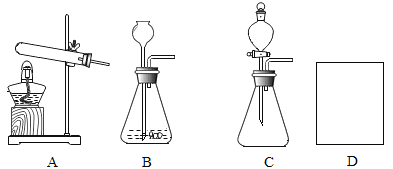
①写出一个用A装置制取O2的化学方程式_____。
②若用B装置制取能使澄清的石灰水变浑浊的气体,则实验室制取该气体的化学方程式是__。与B相比较,C的主要优点是什么______。
③用试管采用排空气法收集氢气,请在D方框中画出装置图(只画试管和导气管)______。
(2)用实验室存放的氢氧化钠溶液做中和反应实验,发现有气泡产生。于是红红判断氢氧化钠变质了。请用化学方程式说明氢氧化钠变质的原因______。
为探究氢氧化钠是否完全变质,红红设计了两个实验方案。
方案1:取少量上述氢氧化钠溶液样品,滴加几滴酚酞溶液,溶液变成红色
方案2:取少量上述氢氧化钠溶液样品,加入饱和石灰水,静置,取上层清液,滴加几滴酚酞溶液。发现溶红色。于是明明认为样品中还会有氢氧化钠,没有完全变质。
①康康认为红红的两个实验方案都不能达到目的,他的理由是____。
②请你设计一个方案来验证氢氧化钠是否完全变质。______。
(3)工业上常用氢氧化钠来中和废水中的盐酸,现取废液50g,逐滴滴入10%的氢氧化钠溶液中和,当溶液pH为7时,用去氢氧化钠溶液8g。请计算废水中氯化氢的质量分数__。
【答案】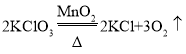
![]() 可以控制反应速度
可以控制反应速度 ![]()
![]() 方案1中,碳酸钠溶液也能使酚酞溶液变红,方案2中碳酸钠与氢氧化钙反应的生成物是氢氧化钠,也能使酚酞溶液变红 取少量上述氢氧化钠溶液样品,加入足量氯化钙溶液(或氯化钡溶液等),静置,取上层清液滴加几滴酚酞溶液,若溶液变成红色,则氢氧化钠没有完全变质;若溶液没有变成红色,则氢氧化钠全部变质 1.46%
方案1中,碳酸钠溶液也能使酚酞溶液变红,方案2中碳酸钠与氢氧化钙反应的生成物是氢氧化钠,也能使酚酞溶液变红 取少量上述氢氧化钠溶液样品,加入足量氯化钙溶液(或氯化钡溶液等),静置,取上层清液滴加几滴酚酞溶液,若溶液变成红色,则氢氧化钠没有完全变质;若溶液没有变成红色,则氢氧化钠全部变质 1.46%
【解析】
(1)①用A装置制取氧气,由于试管口没有塞一团棉花,应该是利用氯酸钾和二氧化锰制取,氯酸钾在二氧化锰的催化以及加热条件下生成了氯化钾和氧气,反应的化学方程式: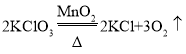 。故填:
。故填: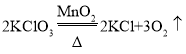 。
。
②能使澄清石灰水变浑浊的气体是二氧化碳,实验室用的药品为大理石和稀盐酸,大理石和稀盐酸反应生成氯化钙、水以及二氧化碳,反应的化学方程式是:![]() ,与B与C的的不同之处主要是一个是长颈漏斗一个是分液漏斗,分液漏斗能够控制液体药品流量,从而控制反应速率,所以与B相比较,C的主要优点是可以控制反应速率。故填:
,与B与C的的不同之处主要是一个是长颈漏斗一个是分液漏斗,分液漏斗能够控制液体药品流量,从而控制反应速率,所以与B相比较,C的主要优点是可以控制反应速率。故填:![]() ;可以控制反应速率。
;可以控制反应速率。
③用试管采用排空气法收集氢气,由于氢气密度比空气小,应该用向下排空气法收集,如图所示:![]() ,故填:
,故填:![]() 。
。
(2)氢氧化钠变质,是因为能和空气中的二氧化碳反应生成碳酸钠和水,反应的化学方程式:![]() ,故填:
,故填:![]() 。
。
①康康认为红红的两个实验方案都不能达到目的,他的理由是碳酸钠溶液显碱性,也能使酚酞试液变红色,碳酸钠和氢氧化钙反应生成氢氧化钠,影响对氢氧化钠的检验。故填:方案1中,碳酸钠溶液也能使酚酞溶液变红,方案2中碳酸钠与氢氧化钙反应的生成物是氢氧化钠,也能使酚酞溶液变红。
②要证明氢氧化钠是否完全变质只需证明样品中是否还存在氢氧化钠即可,但是验证有没有氢氧化钠存在时注意要将碳酸钠完全除尽,防止对氢氧化钠的检验造成干扰,因此可取少量上述氢氧化钠溶液样品,加入足量氯化钙溶液(或氯化钡溶液等),静置,取上层清液滴加几滴酚酞溶液,若溶液变成红色,则氢氧化钠没有完全变质;若溶液没有变成红色,则氢氧化钠全部变质。故填:取少量上述氢氧化钠溶液样品,加入足量氯化钙溶液(或氯化钡溶液等),静置,取上层清液滴加几滴酚酞溶液,若溶液变成红色,则氢氧化钠没有完全变质;若溶液没有变成红色,则氢氧化钠全部变质。
(3)设废水中稀盐酸中溶质的质量为x。
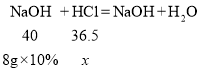
![]()
x=0.73g
废水中氯化氢的质量分数是![]()
答:废水中氯化氢的质量分数是1.46%。


科目:初中化学 来源: 题型:
【题目】某化学兴趣小组将光亮铜片放在酒精灯火焰上灼烧,发现表面变黑,他们对黑色物质来源产生了兴趣,对铜片表面黑色物质的成分进行探究:
(查阅资料)(1)酒精不充分燃烧产生炭黑(即烟灰);
(2)氧气的化学性质比较活泼,加热条件下能与金属铜反应生成黑色的氧化铜。
(猜想与假设)
甲认为: ____________。
乙认为:铜片表面的黑色固体是空气中的氧气与铜反应生成的新物质。
丙认为:铜片表面的黑色固体既有烟灰又有氧气与铜反应生成的新物质。
(进行实验)
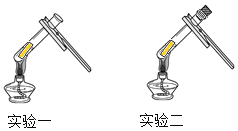
实验步骤和方法 | 实验现象 | 实验结论 |
实验一:取一小段光亮铜片,放入试管内,然后用试管夹夹持试管,放在酒精灯的外焰部位加热。 | 铜片变黑 | 甲、丙的猜想错误。说明黑色物质的出现可能与空气中的________有关。 |
实验二:取一试管,将一小段光亮铜片放入试管中,塞上胶塞,并用注射器抽出试管内的空气,封好胶塞,并加热,趁热取下胶塞,观察现象。 | 取下胶塞前的现象: _____。取下胶塞后的现象:___。 | 乙的猜想正确 |
(反思拓展)
(1)实验一将铜片放入试管中加热,目的是排除了______的干扰。
(2)实验二用注射器抽出试管内空气的目的是________。
(3)通过对黑色物质来源的探究,写出金属铜与氧气反应的化学方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示是一个具有刻度和活塞的可滑动玻璃容器,具有空气和足量的白磷,将他盛放在有废水的烧杯上方进行试验(提示:白磷和红磷化学性质类似,其燃点只需达到 40℃)
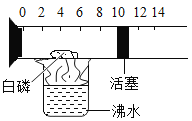
(1)容器内的白磷在沸水的蒸发下燃烧说明燃烧的条件是需要__________
(2)反应结束后,活塞应运动到刻度为_____的位置(假如恰好完全反应)
(3)该实验时使用的白磷量不足,则反应结束后的活塞应运动到较(2)中刻度的_________(选填“偏左”或“偏右”)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)空气、水和食物是人类生命活动离不开的物质
①下列行为能导致空气中PM2.5含量增加的是______________(填字母)。
a.大量使用化石燃料 b.露天焚烧垃圾 c.发展轨道交通,低碳出行
②合理搭配饮食是我们的健康理念。比如早餐搭配:牛奶、面包、黄油、水果等,其中含有的营养素有油脂、糖类、___________、维生素、无机盐和水等。
(2)近年比较流行的“自热火锅”给人们生活带来方便。“自热火锅”主要由料包和发热包(主要成分为生石灰、焙烧硅藻土、活性炭、铁粉、铝粉、碳酸钠等)组成,食用方法如图所示。请回答:
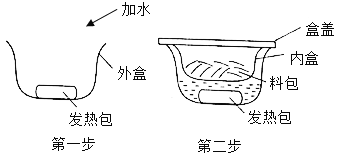
①发热包发热的一种原理是生石灰与水反应放热。反应的化学方程式为____________。
②焙烧硅藻土、活性炭都有疏松多孔的结构,能起到______________作用。
③“自热火锅”的内、外盒由聚丙烯塑料材质制成,随意丢弃会带来______________问题。
(3)东晋葛洪《抱朴子》记载:“以曾青(硫酸铜)涂铁,铁赤色如铜”。请用化学方程式表示其原理____________。
(4)春秋末期齐国的工艺官书《考工记》中载有“洓帛”的方法,即利用“灰(草木灰)和“蜃”(贝壳灰)混合加水所得的溶液来洗涤丝帛。这种溶液能洗涤丝帛主要是因为其中含有______________(写化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】稀土是一种重要的战略资源。铈是一种常见的稀土元素,下列有关铈的说法正确的是

A. 铈属于非金属元素
B. 铈原子的中子数是58
C. 铈原子的核外电子数是58
D. 铈原子的相对原子质量是140.1g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验方案的设计中,没有正确体现对比这种科学思想的是
A. 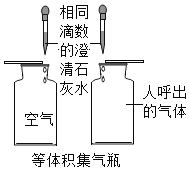 比较二氧化碳的含量
比较二氧化碳的含量
B. 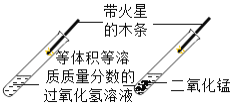 研究二氧化锰的催化作用
研究二氧化锰的催化作用
C.  区分硬水和软水
区分硬水和软水
D. 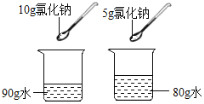 比较氯化钠溶解的快慢
比较氯化钠溶解的快慢
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】钴(Co)的化合物在锂电池中有很好的应用,LiCoO2(钴酸锂)在酸性介质中有强氧化性,其化学方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+4H2O+O2↑,已知锂与钠有相似的化学性质,且反应中只有钴和氧元素的化合价发生了改变,则下列说法正确的是( )
A.该反应是复分解反应
B.该反应中钴的化合价由+3价变为+2价
C.该反应中氧的化合价降低
D.钴酸根离子式![]()
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如下图所示,甲、乙、丙、丁、戊五种物质(或其溶液)俨然是滑冰赛道上参加接力比赛的“运动员”,相邻“运动员”之间能发生化学反应。已知:五种物质分别是Fe、HCl、NaOH、CaCO3和CuCl2中的一种,其中,甲是单质,丁与戊反应产生的气体可以熄灭终点的火炬。

(1)甲能分别与另四种物质中的_____、_____反应(写化学式)。
(2)书写化学方程式:乙+丙_______、丁+戊________。
(3)丙与丁的反应属于______(填基本反应类型)。
(4)若把无机物按单质、氧化物、酸、碱和盐进行分类,无机物 X的类别不同于上述五种物质,如果用X替换戊,它也能与丁反应生成一种生活中常用的液体灭火剂,则X是______(写一种即可),该液体灭火剂为______(写化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用下图装置进行实验。升温至60℃的过程中,仅①燃烧;继续升温至260℃的过程中,仅③燃烧。下列分析不正确的是( )
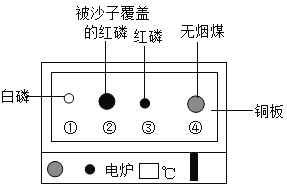
A. ①燃烧,说明白磷是可燃物
B. 对比①③,可说明红磷的着火点比白磷的高
C. 对比②③,可验证燃烧需可燃物与氧气接触
D. ④未燃烧,说明无烟煤不是可燃物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com