
| A. | 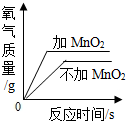 加热等质量的氯酸钾制取氧气 | B. | 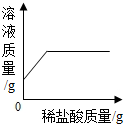 向一定质量的烧碱溶液中加稀盐酸 | ||
| C. | 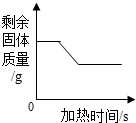 实验室高温加热一定质量的石灰石 | D. | 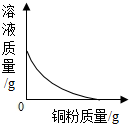 向一定质量的硝酸银溶液中加铜粉 |
分析 A、根据二氧化锰是氯酸钾分解的催化剂,催化剂只会影响反应的速率,不会影响生成氧气的多少进行分析;
B、根据氢氧化钠和盐酸反应生成氯化钠和水进行分析;
C、根据碳酸钙在高温的条件下生成氧化钙和二氧化碳进行分析;
D、根据硝酸银和铜反应生成硝酸铜和银进行分析.
解答 解:A、二氧化锰是氯酸钾分解的催化剂,催化剂只会影响反应的速率,不会影响生成氧气的多少,故A错误;
B、氢氧化钠和盐酸反应生成氯化钠和水,所以溶液的质量应该逐渐的增加,不会出现不变的情况,故B错误;
C、碳酸钙在高温的条件下生成氧化钙和二氧化碳,没有达到碳酸钙的分解温度,固体质量不变,然后质量逐渐减小,分解完后,固体质量不变,故C正确;
D、每64份质量的铜会置换出216份质量的银,所以反应后溶液质量逐渐减小,但是不会减小到零,故D错误.
故选:C.
点评 解答此类问题时,一定要注意到纵横坐标轴的说明文字,这是对曲线所反应规律判断的依据,不可仅凭经验去解答.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:初中化学 来源: 题型:推断题
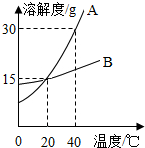 如图是A、B两种固体物质的溶解度曲线图,回答下列问题:
如图是A、B两种固体物质的溶解度曲线图,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 项目 | 实验操作 | 目的分析 |
| A | 称量时,将取出的过量氯化钠放回原瓶 | 节约药品 |
| B | 溶解氯化钠时用玻璃棒搅拌 | 增大氯化钠的溶解度 |
| C | 称取氯化钠时,在天平两边托盘上各放一张质量相等的纸 | 整洁美观 |
| D | 最取所需水量时,视线与量筒内液体凹液面的最低处保持水平 | 准确读数 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 体液 | A、血液 | B、胃液 | C、唾液 | D、胆汁 |
| pH范围 | 7.35-7.45 | 0.8-1.5 | 6.6-7.1 | 6.8-7.4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

| 同学 | 小红 | 小美 | 小伍 |
| 实验操作 | 加入适量氢氧化钙溶液 | 加入过量氯化钙溶液 | 加入过量稀盐酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 酚酞试液遇到白醋不变色 | |
| B. | 石灰水滴加硫酸铜溶液产生蓝色沉淀 | |
| C. | 硝酸铵溶于水使溶液温度降低 | |
| D. | 红磷在空气中燃烧产生大量白雾 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Fe+CuSO4=FeSO4+Cu | B. | 2NO+O2=2NO2 | ||
| C. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | D. | 2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
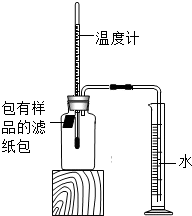 某实验小组对铁的锈蚀进行如下实验.室温时,将包有样品(足量)的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图.观察到量筒内水沿导管慢慢进入广口瓶(容积150mL).当温度恢复至室温,且量筒内水面高度不变时读数.记录起始和最终量筒的读数以及所需时间,如表:
某实验小组对铁的锈蚀进行如下实验.室温时,将包有样品(足量)的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图.观察到量筒内水沿导管慢慢进入广口瓶(容积150mL).当温度恢复至室温,且量筒内水面高度不变时读数.记录起始和最终量筒的读数以及所需时间,如表:| 序号 | 样品 | 量筒起始读数/mL | 量筒最终读数/mL | 所需时间/min |
| ① | 1g铁粉、0.2g碳和10滴水 | 100 | 70 | 约120 |
| ② | 1g铁粉、0.2g碳和10滴水和少量NaCl | 100 | 70 | 约70 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com