
 金属是现代生活和工业生产中应用极为普遍的一类材料.
金属是现代生活和工业生产中应用极为普遍的一类材料.
分析 (1)由图示和金属活动性顺序可得;考虑铝的抗腐蚀性;考虑铝元素的化合价;
(2)依据转化过程可对钛的冶炼过程进行讨论.
解答 解:(1)①由图中Y表面没有气泡可得Y为金属铜;由实验现象可知三种金属的活动性由强到弱的顺序为Al、Fe、Cu故填:Cu,
②铝是一种活泼金属,但常温下铝却有较强的抗腐蚀性,其原因是4Al+3O2=2Al2O3;
③根据“R为金属,发生如下反应:R+CuSO4=Cu+RSO4”,结合铝元素的化合价为+3,故不可能生成RSO4,故“该反应为置换反应”;“R的金属活动性比Cu强”;“若R为Fe,反应后溶液的质量会减小”都正确;故选C.
(2)I.在高温下TiCl4与足量Mg反应置换生成金属Ti,该反应的化学方程式为:TiCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2.
II.上述生产过程中得到的金属钛中混有的少量金属杂质为铁和镁,所以可加入稀盐酸或稀硫酸除去.
故答案为:
(1)①Cu;②4Al+3O2=2Al2O3;③C.
(2)I.TiCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2.II.稀盐酸或稀硫酸.
点评 本题的难度不大,但涉及的知识点较多,其中方程式的书写是重点,应加强化学方程式的书写.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
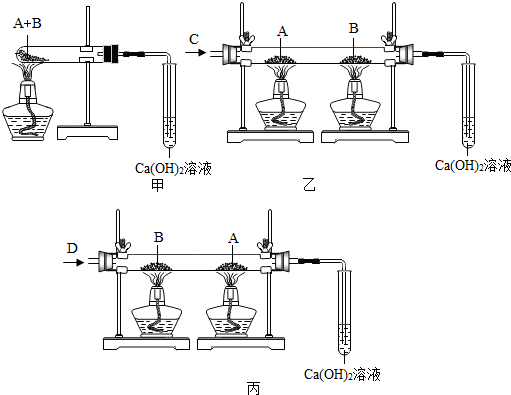
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
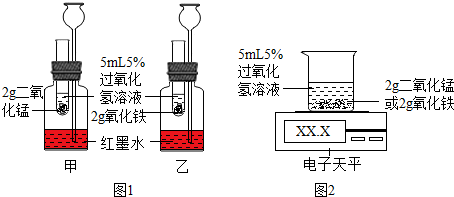
| 实验步骤 | 实验现象 | |
| 实验1 | 在试管中加入少量的H2O2溶液,然后将带火星的木条伸入试管中,观察现象. | 木条不复燃 |
| 实验2 | 在实验1的试管中加入ag的氧化铁,然后将带火星的木条伸入试管中,观察现象. | 木条复燃 |
| 实验3 | 待实验2试管中没有气泡产生后,再加入过氧化氢溶液,然后将带火星的木条伸入试管中,观察现象.反复多次实验. | 木条均复燃 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 只需托盘天平和量筒两种仪器 | |
| B. | 砝码放在左盘上,称取16g无水硫酸铜 | |
| C. | 用量筒量取184mL的水 | |
| D. | 把无水硫酸铜倒入量筒中搅拌溶解 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
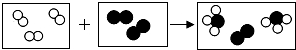 用“○”和“●”分别代表A、B两种原子,如图所示,单质A2与单质B2在一定条件下能发生化学反应生成新物质X.下列说法正确的是( )
用“○”和“●”分别代表A、B两种原子,如图所示,单质A2与单质B2在一定条件下能发生化学反应生成新物质X.下列说法正确的是( )| A. | 在反应过程中A2和B2分子保持不变 | |
| B. | 该反应为置换反应 | |
| C. | 参加反应的A2与B2分子数之比为3:1 | |
| D. | 物质X含三种元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
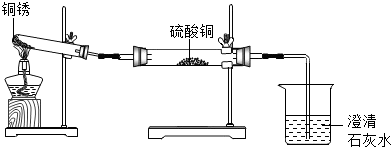
| 实验橾作 | 实验现象 | 实验结论 |
| ①按如图组装仪器,装入药品. ②加热铜锈,直至不再有气体产生,停止加热. | 绿色固体变为黑色;硫酸铜粉末变为蓝色;烧杯中液体变浑浊. | 加热铜锈生成的物质有 CO2、H2O、CuO;铜绣由Cu、C、H、O元素组成;烧杯中发生反应的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O. |
| ③冷却后,向试管中固体 加入适量稀硫酸,稍加热. | 黑色固体溶解,溶液变 为蓝色. |
| 序号 | 实验内容 | 实验结论 | 实验反思 |
| 实验1 |  | 在干燥环境中,铜不易生锈 | (1)实验2和3中使用的是经煮沸后迅速冷却的蒸馏水,其原因是 除去蒸馏水中溶解的O2和CO2. (2)如果要证明铜生锈的快慢是否与二氧化碳的浓度有关,还需要补充的一个实验内容是 按实验4内容重复操作后,再通入一定量的CO2排出部分空气,塞紧胶塞. |
| 实验2 | 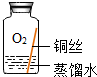 | 在有O2和H2O、无CO2的环境中,铜不易生锈 | |
| 实验3 |  | 在有CO2和H2O、无O2的环境中,铜不易生锈 | |
| 实验4 | 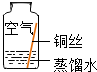 | 铜生锈的条件是 与O2、CO2和H2O同时接触 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com