
分析 (1)根据质量守恒定律分析;
(2)根据氯气的质量求出生成氢氧化钠的质量,进而求出此时溶液所含NaOH的质量分数即可.
解答 解:(1)根据质量守恒定律,反应前后原子的个数不变,得n=2;
故答案为:2;
(2)设生成氢氧化钠的质量为x,生成氢气的质量为y.
2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
80 2 71
x y 7.1g
$\frac{80}{x}=\frac{2}{y}=\frac{71}{7.1g}$
x=8g
y=0.2g
此时溶液所含NaOH的质量分数=$\frac{8g}{100g-0.2g-7.1g}×100%$=8.6%
答:此时溶液所含NaOH的质量分数为8.6%.
点评 反应后所得溶液的质量的计算是一个难点,但只要掌握好方法,所有的问题都会迎韧而解.反应后所得溶液的质量=所加入的所有物质的质量-气体的质量.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:初中化学 来源: 题型:解答题
 某中学综合实践活动小组在进行“诚信商品”研究时,检验商品标签所列成分及含量与实际是否相符.随机取出市售某种“纯碱”样品(成分说明见图)经检验,杂质仅有氯化钠.准确称取样品22g,加入足量氯化钙溶液使其完全反应,将反应生成的沉淀物经过滤、洗涤、干燥后得到白色固体20g.
某中学综合实践活动小组在进行“诚信商品”研究时,检验商品标签所列成分及含量与实际是否相符.随机取出市售某种“纯碱”样品(成分说明见图)经检验,杂质仅有氯化钠.准确称取样品22g,加入足量氯化钙溶液使其完全反应,将反应生成的沉淀物经过滤、洗涤、干燥后得到白色固体20g.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 降低柴禾的着火点 | B. | 增大柴禾与氧气的接触面积 | ||
| C. | 为了好看 | D. | 为了方便加柴禾 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 序号 | 待鉴别的物质 | 鉴别方法 |
| A | 羊毛与涤纶 | 燃烧,闻气味 |
| B | 烧碱与硝酸铵 | 加水,测量液体的温度的变化 |
| C | 铝和铝合金 | 相互刻划 |
| D | 氯化铵与硫酸铵 | 加熟石灰,研磨 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 为探究燃烧的条件,设计如图甲、乙两个实验.请回答:
为探究燃烧的条件,设计如图甲、乙两个实验.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氢气是清洁高能燃料 | B. | 石油是一种不可再生能源 | ||
| C. | 过量排放CO2会形成酸雨 | D. | 淘汰落后产能可减少环境污染 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
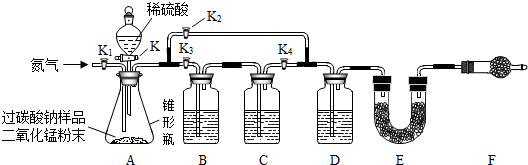
| 序号 | 实验步骤 | 实验现象 | 实验分步结论(或解释) |
| ① | 向盛有过碳酸钠固体的试管中加入适量水 | 固体溶解 | 过碳酸钠易溶于水, 能与水发生反应. |
| ② | 向序号①的所得溶液中加入适量的二氧化锰粉末 | 有大量气泡 产生 | |
| ③ | 将带火星的木条置于试管口 | 木条复燃 | 序号②试管中产生的气体是O2; 过碳酸钠溶于水能生成过氧化氢. |
| ④ | 取序号③试管中的上层清液加入氯化钙溶液 | 产生白色 沉淀 | 反应的化学方程式Na2CO3+CaCl2═CaCO3↓+2NaCl. |
| 小结 | 过碳酸钠与水反应的化学方程式是Na2CO4+H2O═Na2CO3+H2O2. | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com