
���� ��1���������ʼ䷴Ӧ�Ĺ����Լ����ʵ���ɫ����ȷ�����ʵ����ƣ�
��2������1�Ƿ�����������Һ��������ͭ��ɫ������һ�ַ�����
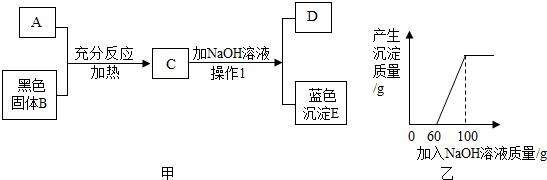
��3����������ͭ���������������ͭ��������Ȼ���������ͭ�������������֮��Ӧ�����������Ƶ�����������ͼ���֪������ͭ��Ӧ������������Һ������Ϊ��100g-60g���������������������Һ�����ʵ�����������
��4����ͼ���֪��C��Һ�е�����Ϊ���������ͭ�������������������߾���Ӧ�����û�ѧ����ʽ�ֱ����������Ƶ��������ɣ�
��� �⣺��1����D�м���Ba��NO3��2��Һ������һ�ֲ�����ϡ����İ�ɫ����������D��Һ��һ��������������ӣ�E����ɫ����������������ͭ����ôC������ͭ��D�������ƣ���ɫ����Ϊ����ͭ����Ϊϡ���ᣬ���H2SO4��
��2������1�Ƿ��������Թ����Һ���һ�ַ������ǹ��ˣ�������ˣ�
��3���⣺����CuO���ɵ�CuSO4������Ϊx
CuO+H2SO4=CuSO4+H2O
80 160
8g x
$\frac{80}{160}=\frac{8g}{x}$
x=16g
����CuSO4��Ӧ��NaOH������Ϊy��ͬʱ����Na2SO4������Ϊa
CuSO4+2NaOH=Cu��OH��2��+Na2SO4
160 80 142
16g y a
$\frac{160}{80}=\frac{16g}{y}$
y=8g
��������������Һ�����ʵ���������Ϊ��$\frac{8g}{100g-60g}��100%$=20%
$\frac{160}{142}=\frac{16g}{a}$
a=14.2g
��NaOH��Һ�����ʵ�����������20%��
��4���⣺���������������Ʒ�Ӧ��������������Ϊb
H2SO4+2NaOH=Na2SO4+2H2O
80 142
60g��20% b
$\frac{80}{142}=\frac{60g��20%}{b}$
b=21.3g
������Һ�����ʵ�����Ϊ��21.3g+14.2g=35.5g
��C��Һ�м���NaOH��Һ��ǡ����ȫ��Ӧʱ��������Һ���ʵ�������35.5g��
���� �����㿼���˸��ݻ�ѧ����ʽ�ļ�������������ļ��㣬�ǿ��Լ������о������ֵ����ͣ�����ʱҪע�⣺��ѧ����ʽҪд��ȷ��ʼ�ղ�Ҫ���������غ㶨�ɣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Һ��һ������Ba2+ | B�� | ����Һ�п��ܺ���SO42- | ||
| C�� | ����Һ��һ������Cl- | D�� | ����Һ��һ������Na+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڸ�������Ϳ������Է�ֹ������ | |
| B�� | 10mL�ƾ���10mLˮ��Ϻ����С��20mL������Ϊ���ӱ�С�� | |
| C�� | ����ɭ�ֻ���ʱ���ɿ��ڷ�����������Ŀ���Ǹ�����ȼ�� | |
| D�� | ��Ǧ��Ͻ���������˿������Ϊ�۵�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��Ӧǰ���������� | ��Ӧ����������� |
| 13.5g | 8.7g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��ijԭ�ӵĽṹʾ��ͼ�����й��ڸ�ԭ�ӵ�������ȷ���ǣ�������
��ijԭ�ӵĽṹʾ��ͼ�����й��ڸ�ԭ�ӵ�������ȷ���ǣ�������| A�� | ���õ����� | B�� | ���ڷǽ���ԭ�� | ||
| C�� | �˵����Ϊ11 | D�� | ����������Ϊ11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ͳ�������кͷ�Ӧ������ | |
| B�� | �ձ�����ʱӦ������ʯ������ | |
| C�� | �¶ȼƿ����ڽ�����Һ | |
| D�� | Ϩ��ƾ��ƣ����õ�ñ����Ҳ�����촵�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���Ʋ�ϡ��һ������������Na2SO4��Һ��
���Ʋ�ϡ��һ������������Na2SO4��Һ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C+O2$\frac{\underline{\;��ȼ\;}}{\;}$CO2 | B�� | Mg+2HCl�TMgCl2+H2�� | ||
| C�� | CaO+H2O�TCa��OH��2 | D�� | CO2+C$\frac{\underline{\;����\;}}{\;}$2CO |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com