【答案】
分析:书写化学方程式时,必须熟悉反应物、生成物和反应条件,必须依据质量守恒定律的两个原则.
只有熟悉四种基本反应类型的概念和特点,才能作出正确的判断.
解答:解:(1)取少量生石灰,装入一支试管中,再向试管中滴加稀盐酸,若有气泡产生,则能证明生石灰中含有石灰石.该反应由碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳
该反应的化学方程式为:CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑.
该反应由两种化合物互相交换成分形成两种新的化合物,符合复分解反应的概念,属于复分解反应.
(2)用高温煅烧的方法可以将生石灰中的碳酸钙除去.该反应由碳酸钙在高温条件下反应生成氧化钙和二氧化碳.
该反应的化学方程式为:CaCO
3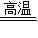
CaO+CO
2↑.
该反应由一种物质反应生成两种物质,符合分解反应的概念,属于分解反应.
(3)可以将铜片放入硝酸银溶液中,通过观察现象来进行判断.该反应由铜和硝酸银反应生成银和硝酸铜.
该反应的化学方程式为:Cu+2AgNO
3=2Ag+Cu(NO
3)
2.
该反应由一种单质和一种化合物反应生成另一种单质和另一种化合物,符合置换反应的概念,属于置换反应.
(4)取两种无色酸溶液各少量与两支试管中,再分别滴入几滴氯化钡溶液,有白色沉淀生成的是硫酸,没有白色沉淀生成的是盐酸.上述操作中的反应是硫酸和氯化钡反应生成了硫酸钡和盐酸.
该反应的化学方程式为:BaCl
2+H
2SO
4=BaSO
4↓+2HCl.
该反应由两种化合物互相交换成分形成两种新的化合物,符合复分解反应的概念,属于复分解反应.
故答案为:
(1)CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;复分解反应.
(2)CaCO
3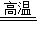
CaO+CO
2↑;分解反应.
(3)Cu+2AgNO
3=2Ag+Cu(NO
3)
2;置换反应.
(4)BaCl
2+H
2SO
4=BaSO
4↓+2HCl;复分解反应.
点评:本题主要考查物质的除杂和鉴别、金属活动性顺序和基本反应类型的判断,难度较大.

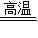 CaO+CO2↑.
CaO+CO2↑.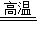 CaO+CO2↑;分解反应.
CaO+CO2↑;分解反应.

 阅读快车系列答案
阅读快车系列答案