

| A. | 镁原子的核电荷数为12 | |
| B. | 镁原子的相对原子质量为24.31g | |
| C. | 镁属于非金属元素 | |
| D. | 在化学反应中,镁原子容易得到电子 |
分析 图中元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量;
原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层.若原子的最外层电子数≥4,在化学反应中易得电子,若最外层电子数<4,在化学反应中易失去电子.
解答 解:A、由镁原子的结构示意图,圆圈内数字表示核内质子数(核电荷数),镁原子的核电荷数为12,故选项说法正确.
B、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为24.31,相对原子质量单位是“1”,不是“克”,故选项说法错误.
C、镁带“钅”字旁,属于金属元素,故选项说法错误.
D、最外层电子数是2,在化学反应中易失去2个电子而形成阳离子,故选项说法错误.
故选:A.
点评 本题难度不大,灵活运用元素周期表中元素的信息(原子序数、元素符号、元素名称、相对原子质量)、原子结构示意图的含义是正确解答本题的关键.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:选择题
| A. | 加入10克食盐固体 | B. | 把溶液中的水蒸发掉一半 | ||
| C. | 加入100克10%的食盐溶液 | D. | 把水蒸发掉50克 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
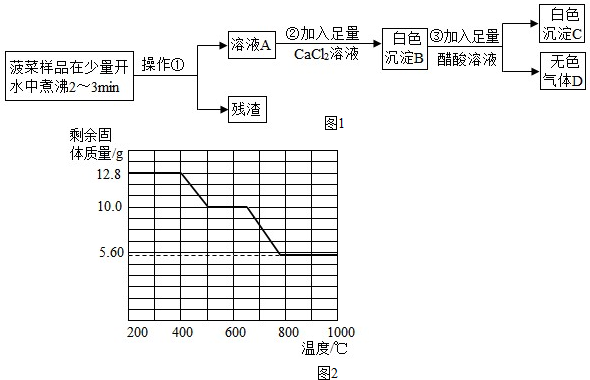
| 实验操作 | 实验现象 | 实验结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
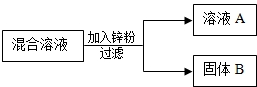 某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了右图实验,对固体B的成分进行了分析和实验探究.
某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了右图实验,对固体B的成分进行了分析和实验探究.| 实验步骤 | 现象 | 由此确定固体B的成分写出反应的化学方程式 |
| 取少量固体B,滴加(4)稀盐酸 | 有气泡产生 | (5)Zn+2HCl=ZnCl2+H2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验目的 | 实验操作 | 实验现象 |
| ①证明粉末中是否含有铜 | 取一个小烧杯,加入适量的粉末,再向其中加入足量的稀盐酸或稀硫酸. | 有少量红色粉末不能溶解. |
| ②证明粉末中是否含有锰 | 取5.5克粉末放入烧杯,再向其中加入适量的硫酸亚铁溶液,反应完全后过滤、干燥,称量固体为5.52克. | 绿色溶液变为浅粉色. |
| ③证明粉末中是否含有铁 | 另取5.5克粉末,用磁铁充分吸引(用物理方法), 称量剩余金属粉末为1.12克. | 有大量黑色粉末被磁铁吸引. |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 酒精能使蛋白质变性,可用于杀菌消毒 | |
| B. | CaO能与SO2反应,可作工业废气的脱硫剂 | |
| C. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 | |
| D. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com