
| A. | 送木条是易燃物,硫磺是阻燃物 | B. | “法烛”燃烧会产生刺鼻气味 | ||
| C. | 硫磺降低了松木的着火点 | D. | 吹灭“法烛”是因为隔绝了空气 |
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
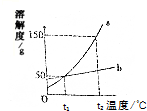 如图是a、b两种固体物质(不含结晶冰)的溶解度曲线,下列叙述错误的是( )
如图是a、b两种固体物质(不含结晶冰)的溶解度曲线,下列叙述错误的是( )| A. | t2℃时,a的溶解度大于b的溶解度 | |
| B. | t2℃时,a的饱和溶液的溶质的质量分数为t1℃时的3倍 | |
| C. | b中含有少量a,可以用恒温蒸发溶剂的方法提纯b | |
| D. | t1℃时,等质量的a、b两种物质的饱和溶液中溶质质量一定相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 右图为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线
右图为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线查看答案和解析>>
科目:初中化学 来源: 题型:填空题
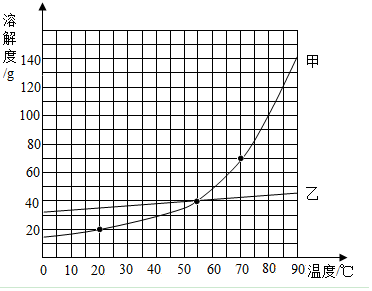 如图是甲乙两种固体物质(不含结晶水)的溶解度曲线,根据图象回答下列问题.
如图是甲乙两种固体物质(不含结晶水)的溶解度曲线,根据图象回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁钉浸入硫酸铜溶液中,铁钉变红,铁没有铜活泼 | |
| B. | 氢气通入灼热的氧化铜粉末中,红色粉末变黑,氢气具有还原性 | |
| C. | 向汗液中滴入硝酸银溶液和稀硝酸,产生白色沉淀,汗液中含有氯离子 | |
| D. | 纯碱与盐酸混合,有气泡产生,纯碱与盐酸发生中和反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 同学们通过查阅资料知道,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化镁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶以及氧化铜等.
同学们通过查阅资料知道,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化镁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶以及氧化铜等.| 时间/s 试剂 压强/KPa | 0 | 60 | 120 | 180 | 240 | 300 |
| 20mL5%的过氧化氢溶液 | 101.86 | 102.99 | 103.42 | 103.67 | 103.99 | 104.00 |
| 加入氯化铁溶液 | 102.21 | 105.35 | 115.40 | 129.69 | 145.52 | 163.99 |
| 加入氯化铜溶液 | 101.50 | 102.73 | 107.53 | 114.78 | 122.49 | 130.39 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

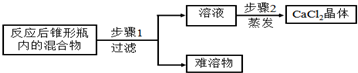
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com