
分析 (1)利用溶质质量=溶液质量×溶质的质量分数,可根据溶液的质量和溶质的质量分数计算配制溶液所需要的溶质的质量;进而溶剂质量=溶液质量-溶质质量,计算出所需水的质量,由所需水的体积判断所需量筒的量程.
(2)根据溶液稀释前后,溶质的质量不变,结合题意进行分析解答.
解答 解:(1)溶质质量=溶液质量×溶质的质量分数,配制100g溶质质量分数为7.5%的氯化钠溶液,需氯化钠的质量=100g×7.5%=7.5g;溶剂质量=溶液质量-溶质质量,则所需水的质量=100g-7.5g=92.5g(合92.5mL).
(2)设要加水的质量为x,根据溶液稀释前后,溶质的质量不变,
则(100g+x)×0.5%=7.5g x=1400g(水的密度为1g∕mL,合1400mL).
故答案为:(1)7.5;92.5;(2)1400.
点评 本题难度不大,掌握溶质质量=溶液质量×溶质的质量分数、溶剂质量=溶液质量-溶质质量、溶液稀释前后溶质的质量不变是正确解答此类题的关键所在.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:初中化学 来源: 题型:选择题
| A. | NaCl、KNO3.(NH4)2SO4 | B. | HC1、AgNO3.Na2SO4 | ||
| C. | KMnO4、CuCl2、Fe2(SO4)3 | D. | H2SO4、K2CO3、NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 实验现象 | 结论与化学方程式 |
| A中出现黑色固体;B中澄清石灰水变浑浊;D中溶液逐渐变为墨绿色;F中烧杯内壁出现无色液滴. | B中发生反应的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O;装置E中药品的作用是除去气体中混有的水蒸气;收集的气体样品中一定含有H2S、CO2、CH4、O2. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| 取样于试管中,加水溶解,往上层溶液中滴加无色酚酞 | 溶液显红色 | 变质的熟石灰中仍含氢氧化钙 |
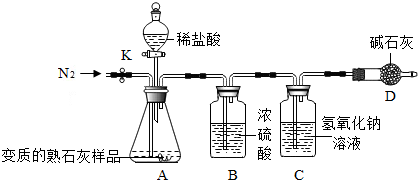
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 该气体可能只含有CO、H2 | B. | 该气体可能只含有CH4、CO | ||
| C. | 该气体一定只含有CH4 | D. | 该气体一定只含有CH4、H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com