
分析 (1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答;
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析;
(3)根据化合物中元素的质量分数=$\frac{相对原子质量×原子个数}{相对分子质量}$×100%,进行分析解答.
解答 解:(1)碳酸亚铁的相对分子质量是56+12+16×3=116.故填:116;
(2)碳酸亚铁中铁元素、碳元素、氧元素的质量比=56:12:(16×3)=14:3:12;故填:14:3:12;
(3)碳酸亚铁中铁元素的质量分数=$\frac{56}{116}×100%$≈48.3%;故填:48.3%.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 请回答:该原子的质子数为12,化学反应中易失去电子(选填“得到”或“失去”),其离子符号为Mg2+;
请回答:该原子的质子数为12,化学反应中易失去电子(选填“得到”或“失去”),其离子符号为Mg2+;
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaOH NaC1 CuSO4 HC1 | B. | KNO3 Na2SO4 NaOH KC1 | ||
| C. | KC1 Ba(NO3)2 HC1 CaC12 | D. | Na2CO3 Ba(OH)2 KNO3 Na2SO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
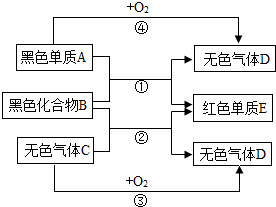 已知A,B,C,D,E是初中化学中常见的五种物质,气体D能使澄清石灰水变浑浊,它们之间有如图所示的转化关系
已知A,B,C,D,E是初中化学中常见的五种物质,气体D能使澄清石灰水变浑浊,它们之间有如图所示的转化关系查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫+氧气$\stackrel{点燃}{→}$二氧化硫 | B. | 氧化汞$\stackrel{加热}{→}$汞+氧气 | ||
| C. | 氢气+氧气$\stackrel{点燃}{→}$水 | D. | 乙炔+氧气$\stackrel{点燃}{→}$二氧化碳+水 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
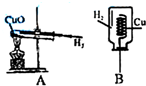 实验是进行科学探究的重要途径.在探究过程中,很多因素都会对实验结果产生影响.
实验是进行科学探究的重要途径.在探究过程中,很多因素都会对实验结果产生影响.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com