
| 实验操作 | 测定结果 | 白色固体成分 |
| 用pH试纸测定反应后溶液的酸碱度,操作方法是 | pH>7 | |
| CaCl2 |
分析 (1)根据复分解反应的条件分析;
(2)根据溶液pH的测定方法及酸碱中和的程度分析溶液的pH及成分;
(3)①根据溶解、过滤和蒸发操作中所用的仪器来考虑;
②根据会与碳酸根离子生成沉淀的有哪些物质进行分析;
③经上述方案处理后的溶液呈碱性,加入稀盐酸可以除去过量的氢氧化钠和过量的碳酸钠.
(4)①根据氢氧化钠的质量和方程式计算Al2O3的质量,进一步计算铝土矿中Al2O3的质量分数
②根据质量守恒分析加入的NaOH溶液中水的质量.
解答 解:(1)复分解反应发生的条件是有沉淀析出,或有气体放出,或有水(或难电离物)生成;故答案为:水(或难电离物);
(2)测溶液pH值具体方法:用洁净玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较;用pH试纸测定反应后溶液的酸碱度是pH>7,说明是氢氧化钙剩余,因此白色固体中含有生成的氯化钙和剩余的氢氧化钙;因为白色固体是氯化钙,因此可能是酸碱完全反应,pH=7;也可能是盐酸剩余,在蒸发过程中挥发走了,只剩下氯化钙,所以pH<7;
(3)①在溶解、过滤和蒸发操作中都用到的玻璃仪器是玻璃棒,在蒸发操作中的作用是搅拌,使受热均匀,防止液滴飞溅;
②碳酸钠中的碳酸根离子会与钡离子和钙离子反应生成碳酸钡和碳酸钙沉淀,因此加入Na2CO3溶液的目的是除去溶液中的钙、钡离子;
③经上述处理后的溶液中还含有氢氧化钠和碳酸钠等杂质,呈碱性,因此,还需加入适量稀盐酸和氢氧化钠、碳酸钠反应,从而把过量的氢氧化钠、碳酸钠除去,调节溶液的PH=7.
(4)①设Al2O3的质量为x
Al2O3+2NaOH=2NaAlO2+H2O
102 80
x 160kg
$\frac{102}{80}=\frac{x}{160kg}$ 解得:x=204kg
铝土矿中A12O3的质量分数:$\frac{204kg}{340kg}$×100%=60%
②加入的NaOH溶液中水的质量1004kg-204kg-160kg=640kg.
故答为:(1)水;(2)
| 实验操作 | 测定结果 | 白色固体成分 |
| 操作方法是 用洁净玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较. | CaCl2、Ca(OH)2 |
点评 本题是一道综合性的问题的考查,利用复分解反应的条件、酸碱中和反应程度的判断方法等相关的知识点进行逐项分析.


科目:初中化学 来源: 题型:填空题
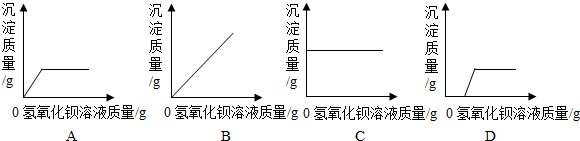
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 人类的生活和生产都离不开金属材料.
人类的生活和生产都离不开金属材料.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用纯碱溶液除去水壶中的水垢 | |
| B. | 钢铁制品在干燥的空气中易生锈 | |
| C. | 硫酸铜可用于游泳池水消毒,也可用于自来水消毒 | |
| D. | 用聚乙烯塑料制成的包装袋可包装食品 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 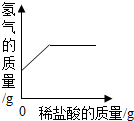 向一定量铁粉中滴加稀盐酸液 向一定量铁粉中滴加稀盐酸液 | |
| B. |  用酒精灯加热一定量KMnO4固体 用酒精灯加热一定量KMnO4固体 | |
| C. |  向一定量硫酸铜溶液中加入NaOH溶液 向一定量硫酸铜溶液中加入NaOH溶液 | |
| D. |  向盛有MnO2的烧杯中加入H2O2溶液 向盛有MnO2的烧杯中加入H2O2溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
| 组别 药品 | 甲 | 乙 | 丙 |
| 稀硫酸/g | 200 | 200 | 300 |
| 粗锌样品/g | 40 | 30 | 30 |
| 生成气体/g | 0.8 | 0.8 | 0.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | “侯氏制碱法”中的“碱”--NaOH | |
| B. | 体温表中的水银不是银,是金属汞 | |
| C. | “请往菜里加点盐”中的“盐”特指食盐--NaCl | |
| D. | 生活中常用的铁制品一般是铁的合金 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
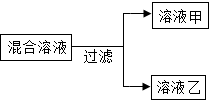 化学小组用一定量的AgNO3和Cu(NO3)2混合溶液进行了如图实验,当溶液甲恰好呈浅绿色,需向混合溶液加入适量的铁;溶液甲中一定含有的溶质是Cu(NO3)2、Fe(NO3)2(写化学式),请写出该实验过程中的方程式Fe+2AgNO3=Fe(NO3)2+2Ag(写出一个即可)
化学小组用一定量的AgNO3和Cu(NO3)2混合溶液进行了如图实验,当溶液甲恰好呈浅绿色,需向混合溶液加入适量的铁;溶液甲中一定含有的溶质是Cu(NO3)2、Fe(NO3)2(写化学式),请写出该实验过程中的方程式Fe+2AgNO3=Fe(NO3)2+2Ag(写出一个即可)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com