
【题目】工业上利用某废渣(含FeSO4、Fe2(SO4)3及少量CaO和MgO)制备高档颜料铁红(主要成分为Fe2O3)和回收(NH4)2SO4,其生产流程如下:

已知:a、氧化还原反应中,会有元素化合价发生变化。
b、![]() 回答下列问题:
回答下列问题:
(1)(NH4)2Fe6(SO4)4(OH)12中铁元素的化合价是_____。
(2)粉碎废渣的目的_____,加入物质X溶解废渣,X应选用_____(填序号)。
A 盐酸
B 硫酸
C 氨水
D 氢氧化钠
步骤①酸浸时,生成盐的化学方程式为_____(任写一个)。
(3)步骤③中操作Y的名称是____,滤液中除含有很少量铵黄铁矾外还含有__。
(4)步骤②通入氧气氧化的目的是_____,工业上对该操作控制在4小时左右为宜,根据如图有关数据分析,影响Fe3+氧化率的变化规律:_____。
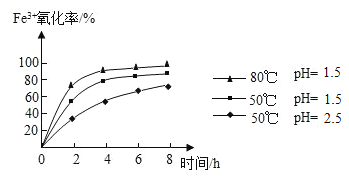
【答案】+3 增大反应物之间的接触面积,使反应充分进行 B ![]() (或
(或![]() ) 过滤 硫酸钙、硫酸镁、硫酸铵[或CaSO4、MgSO4、(NH4)2SO4] 将亚铁离子(或Fe2+)氧化成三价铁离子(或Fe3+) 温度越高,pH越小(或酸性越强),三价铁离子(或Fe2+)氧化率越高
) 过滤 硫酸钙、硫酸镁、硫酸铵[或CaSO4、MgSO4、(NH4)2SO4] 将亚铁离子(或Fe2+)氧化成三价铁离子(或Fe3+) 温度越高,pH越小(或酸性越强),三价铁离子(或Fe2+)氧化率越高
【解析】
氧化镁和硫酸生成硫酸镁和水,氧化钙和硫酸生成硫酸钙和水,粉碎废渣的目的增大反应物之间的接触面积,使反应充分进行。
(1)(NH4)2Fe6(SO4)4(OH)12中铵根离子的化合价为+1价,硫酸根离子的化合价为-2价,氢氧根离子的化合价为-1价,设铁元素的化合价是x,化合物中各元素的正负化合价代数和为零,则![]() ,
,![]() ,故铁元素的化合价是+3价。
,故铁元素的化合价是+3价。
(2)粉碎废渣的目的增大反应物之间的接触面积,使反应充分进行,废渣中含有氧化钙和氧化镁,氧化镁和硫酸生成硫酸镁和水,氧化钙和硫酸生成硫酸钙和水,加入物质X溶解废渣,X应选用硫酸,故选B。
步骤①酸浸时,生成盐的反应是氧化镁和硫酸生成硫酸镁和水,或氧化钙和硫酸生成硫酸钙和水,故反应的化学方程式为![]() (或
(或![]() )。
)。
(3)步骤③中操作Y是将固体和液体分离,故名称是过滤,氧化镁和硫酸生成硫酸镁,氧化钙和硫酸生成硫酸钙,氨水和硫酸铁生成硫酸铵,故滤液中除含有很少量铵黄铁矾外还含有硫酸钙、硫酸镁、硫酸铵[或CaSO4、MgSO4、(NH4)2SO4]。
(4)生产流程需要将硫酸亚铁氧化成硫酸铁和氨水反应,故步骤②通入氧气氧化的目的是将亚铁离子(或Fe2+)氧化成三价铁离子(或Fe3+),由图像可知,铁离子的氧化率随着酸性的减弱而减小,故工业上对该操作控制在4小时左右为宜,根据如图有关数据分析,影响Fe3+氧化率的变化规律是温度越高,pH越小(或酸性越强),三价铁离子(或Fe2+)氧化率越高。


科目:初中化学 来源: 题型:
【题目】某研究性学习小组利用下图装置进行一氧化碳还原氧化铁的实验。

回答下列问题:
(1)实验开始时,首先应___________________;实验中通入CO2的作用:①排出装置内的空气,②____________________(用化学方程式表示)。
(2)写出一氧化碳还原氧化铁的化学反应方程式_________________,该反应____(选填“是”或“否”)置换反应。
(3)丁处试剂瓶中发生的主要反应的化学方程式____________________。
(4)对该装置你认为下列说法正确的是___________(选填序号)。
a.丙处试管可防止液体倒吸 b.该装置的不足之处是未进行尾气处理
(5)当观察到____________________________(填实验现象),停止加热,待冷却后,用磁铁吸引硬质玻璃管中的黑色粉末,黑色粉末被吸起。小军同学说,该黑色粉末是铁。小明说,该黑色粉末不一定是铁。于是,他们对生成的黑色粉末进行探究。查阅资料:
① CO还原Fe2O3的产物与反应温度有关。
②Fe3O4为黑色粉末,能与盐酸反应,含有Fe3+的盐溶液遇到KSCN(硫氰化钾)溶液时变成红色,Fe(OH)2是一种白色沉淀,在空气中易被氧气氧化。进行实验:
实验操作 | 现 象 |
步骤一:取黑色粉末加入盐酸 | 溶解,无气泡,溶液呈浅黄绿色 |
步骤二:取步骤一所得溶液,滴加KSCN溶液 | 溶液变红 |
步骤二:再取步骤一所得溶液,加入足量的NaOH溶液 | 有红褐色沉淀生成,同时还有少量的白色沉淀生成,白色沉淀迅速变成灰绿色,最后面变成红褐色 |
实验结论:①黑色粉末是_________(填名称)。
②写出黑色粉末与盐酸反应的化学方程式_________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国拥有自主知识产权的硅衬底高光效氮化镓发光二极管(简称LED)技术,已广泛用于照明、显像等多个领域。氮和镓的原子结构示意图及镓在元素周期表中的信息如下图所示,下列说法正确的是( )

A. 镓元素位于第三周期,属于金属元素B. 镓原子核内有31个中子
C. 镓的相对原子质量是69.72gD. 氮化镓的化学式为GaN
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某无色溶液中可能含有NaCl、H2SO4、Na2CO3、BaCl2、MgCl2中的一种或几种,取适量该溶液与氢氧化钠溶液反应,产生沉淀的质量与加入氢氧化钠溶液质量之间的关系如下图所示。下列说法正证确的是( )

A.O→A、B→C过程中均没有发生化学反应
B.该溶液中一定含有H2SO4、MgCl2
C.该溶液中一定没有Na2CO3、BaCl2、NaCl
D.C点对应溶液中的溶质有NaCl、NaOH
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国拥有自主知识产权的硅衬底高光效氮化镓发光二极管(简称LED)技术,已广泛用于照明、显像等多个领域。氮和镓的原子结构示意图及镓在元素周期表中的信息如下图所示,下列说法正确的是( )
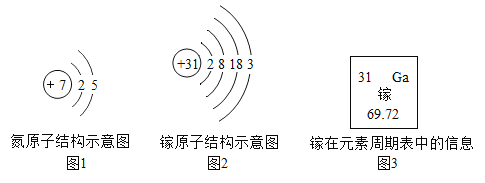
A. 镓元素位于第三周期,属于金属元素B. 镓原子核内有31个中子
C. 镓的相对原子质量是69.72gD. 氮化镓的化学式为GaN
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某无色溶液中可能含有NaCl、H2SO4、Na2CO3、BaCl2、MgCl2中的一种或几种,取适量该溶液与氢氧化钠溶液反应,产生沉淀的质量与加入氢氧化钠溶液质量之间的关系如下图所示。下列说法正证确的是( )

A.O→A、B→C过程中均没有发生化学反应
B.该溶液中一定含有H2SO4、MgCl2
C.该溶液中一定没有Na2CO3、BaCl2、NaCl
D.C点对应溶液中的溶质有NaCl、NaOH
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】物质氧化钠由钠离子和氧离子构成。
(1)1个钠离子的化学符号是_____。
(2)画出氧离子的结构示意图_____。
(3)氧化钠中氧元素的化合价_____。
(4)氧化钠可以和水在常温下生成火碱,请写出氧化钠与水反应的化学方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~H是初中化学常见物质。单质A在空气中因“生锈”而使得表面变绿,绿色物质的主要成分与B反应生成C,C常用于配制农药波尔多液。D与常温下呈液体的E反应只生成F,F与纯碱溶液反应生成G和H,H高温煅烧生成D。
(1)A的化学式为_________________。
(2)D俗称为________________,D变成F的过程是________________ (填“放热”或“吸热”)过程,F在日常生活的一种用途为________________。
(3) C与F反应的化学方程式为________________,其基本反应类型为________________。
(4) F与纯碱反应的化学方程式为________________,G的物质类别属于________________ (填 “酸”或“碱”或“盐”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com