
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 操作方法 |
| A | H2 | CO | 通过灼热的氧化铁 |
| B | HCl | K2SO4 | 加入过量氯化钡溶液、过滤、蒸发 |
| C | MnO2 | K2MnO4 | 加入足量的水溶解,过滤后洗涤干燥 |
| D | NaOH溶液 | Na2CO3 | 加入足量稀盐酸至不再产生气泡后,将溶液蒸发至干 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 催化剂在化学反应中不能增加生成物的质量 | |
| B. | 电解水的实验中正极和负极生产的两种气体质量比1:2 | |
| C. | 电解水中正极产生的是氧气 | |
| D. | 点燃和加热可燃性气体前,检验其纯度 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | +2 | B. | +4 | C. | +6 | D. | -4 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 在化学反应中分子可分,原子不可分 | |
| B. | 分子质量大,原子质量小 | |
| C. | 分子间有间隔,原子间无间隔 | |
| D. | 分子体积大,原子体积小 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
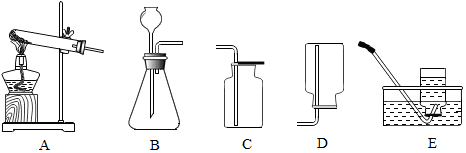 如图是实验室制取氧气的常用装置:
如图是实验室制取氧气的常用装置:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 25 mL | B. | 小于15mL | C. | 等于15mL | D. | 大于15mL |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 我国海岸线长达3.2万千米,海洋专属经济区幅员辽阔,海洋资源丰富,开发的前景十分远大.
我国海岸线长达3.2万千米,海洋专属经济区幅员辽阔,海洋资源丰富,开发的前景十分远大. 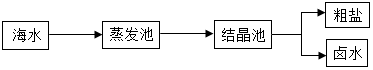

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com